(湖北工业大学发酵工程教育部重点实验室/工业发酵湖北省协同创新中心,武汉 430068)
摘要:以胶体甲壳素作为惟一碳源,从自然界微生物中筛选并诱导到一株产甲壳素酶活性较高的菌株,经16S rDNA鉴定为Aeromonas sp.。并以该菌株作为出发菌株,经过一次紫外诱变,酶活是初筛菌株的1.48倍。再经过二次紫外诱变或者紫外-LiCl复合诱变,酶活分别是初筛菌株的3.16和3.87倍,最高酶活达到3.48 U/mL。最后通过连续传代培养,确定了菌株HMX-16经过紫外和复合诱变后突变性状稳定性良好。
关键词 :甲壳素酶;紫外诱变;紫外-LiCl复合诱变;产酶活性
中图分类号:Q93-331;Q933 文献标识码:A 文章编号:0439-8114(2015)05-1062-04
DOI:10.14088/j.cnki.issn0439-8114.2015.05.009
收稿日期:2014-12-16
基金项目:湖北工业大学高层次人才启动项目(BSQD0813);2013年全国大学生创新创业训练计划项目(201210500030)
作者简介:夏 祥(1988-),男,安徽淮北人,在读硕士研究生,研究方向为生物可再生资源的利用和发酵工程,(电话)15608643331(电子信箱)
905633216@qq.com;通信作者,胡 瑛(1975-),女,副教授,主要从事再生资源生物利用和生物活性物质的生物转化研究,(电子信箱)
huying@mail.hbut.edu.cn。
甲壳素作为一种结构多糖在自然界分布广泛,广泛存在于甲壳动物的外壳、节肢动物的骨骼以及真菌和藻类的细胞壁中,是地球上除纤维素外的二大生物资源,也是保健食品、医用材料和化妆品工业的重要原料[1,2]。由于甲壳素分子很大,分子之间存在强烈的分子间和分子内氢键作用,很难溶于酸、碱和一般的有机溶剂,从而大大限制了甲壳素的应用。和大分子甲壳素相比,甲壳低聚糖无毒、易被人体吸收,并具有抗肿瘤、增强免疫力、抗菌、降胆固醇、保湿及促进植物抗逆生长等多种生理功能,在食品、医药、农业等领域有着广泛的应用前景,成为近年来的研究热点[3]。酶法生产甲壳低聚糖具有条件温和、水解反应易于控制、不造成环境污染等优点,特别是专一性酶亲和力强,选择性高,产品质量好,所以,采用酶法降解甲壳素一直是目前国内外研究的热点[4]。但目前专一性甲壳素酶价格昂贵,活性较低,难以商品化,因此寻求高活性的产甲壳素酶菌株仍是目前甲壳低聚糖研究和应用开发的关键[5]。
甲壳素酶(Chitinase,EC.3.2.1.14)是一类能催化降解甲壳素β-1,4?蛳糖苷键的水解酶,可以根据其酶切位置不同,分为内切甲壳素酶和外切甲壳素酶,外切甲壳素酶可分为甲壳二糖酶和N-乙酰氨基葡萄糖酶。甲壳素酶广泛存在于动物、植物以及微生物(细菌、放线菌、真菌)中[6],据统计,迄今已发现约50个属近100种甲壳素酶产生菌[7-9],在植物病虫害防治和甲壳素生物资源利用等领域有广泛的应用前景。目前,虽然已经从多种微生物中分离出甲壳素酶,但大多数产酶能力都较低。而诱变育种是筛选菌株最常用的方式之一[10,11]。紫外线辐照是一种较为常用的物理诱变方式,操作方便、安全,没有化学诱变剂毒性,对原核生物而言是一种比较好的诱变因素。氯化锂是一种碱金属卤化物,单独使用是一种弱诱变剂,但可协同作用来提高诱变效果。
本研究采用透明圈法从自然界微生物中筛选到一株产甲壳素酶活性较高的菌株,采用物理诱变、复合诱变处理,最后通过连续传代培养,筛选出一株产甲壳素酶活性较高并稳定性良好的菌株。
1 材料与方法
1.1 材料
1.1.1 菌株与仪器 菌株来源于湖北省所取得的土样,所用试剂均为分析级。超净工作台(SW-CJ-1D型,苏州净化设备有限公司)、恒温培养箱(HP300GS-C型智能人工气候箱,武汉瑞华仪器有限责任公司)、离心机(TG16-11型高速离心机,长沙平凡仪器仪表有限公司)、分光光度计(WFJ2000型分光光度计,上海智城分析仪器制造有限责任公司)。
1.1.2 10 g/L胶体甲壳素制备 称取商用甲壳素20 g,溶于130 mL 50%的硫酸中,用玻璃棒搅拌均匀,放置于4 ℃冰箱溶解2 d。完全溶解后,过滤除去杂质。加入3倍以上体积的无水乙醇。4 ℃醇沉过夜,用去离子水洗涤,8 000 r/min离心20 min,去掉多余的水分,再洗涤直至pH 6.5,最后用去离子水定容到2 L[12]。
1.1.3 培养基 10 g/L胶体甲壳素和含其他培养基成分的水溶液分开灭菌,使用前等体积混合。
1)富集培养基:最终浓度为甲壳素5 g/L,K2HPO4 0.7 g/L, KH2PO4 0.3 g/L, 酵母粉5 g/L,MgSO4·7H2O 0.5 g/L, NaCl 5 g/L,(NH4)2SO4 10 g/L , 去离子水 1 000 mL, pH 7.0。
2)初筛平板培养基:最终浓度为甲壳素5 g/L,(NH4)2SO4 10 g/L, K2HPO4 0.7 g/L,KH2PO4 0.3 g/L, NaCl 5 g/L, MgSO4·7H20 0.5 g/L, 琼脂20 g/L,,去离子水1 000 mL, pH 6.5。
3)斜面(种子)培养基:最终浓度为甲壳素5 g/L,(NH4)2SO4 10 g/L, K2HPO4 0.7 g/L, KH2PO4 0.3 g/L, NaCl 5 g/L, MgSO4·7H2O 0.5 g/L,酵母粉 5 g/L,蛋白胨10 g/L,琼脂20 g/L,去离子水1 000 mL, pH 6.5。
4)发酵复筛培养基:最终浓度为甲壳素5 g/L,(NH4)2SO4 10 g/L, K2HPO4 0.7 g/L, KH2PO4 0.3 g/L, MgSO4·7H2O 0.5 g/L,去离子水1 000 mL, pH 6.5。
5)含氯化锂培养基:最终浓度为甲壳素5 g/L,LiCl 3 g/L, (NH4)2SO4 10 g/L, K2HPO4 0.7 g/L, KH2PO4 0.3 g/L, MgSO4·7H2O 0.5 g/L,琼脂20 g/L,去离子水1 000 mL, pH 6.5。
1.2 方法
1.2.1 产甲壳素酶菌种的筛选及鉴定 采集湖北省水产加工厂周围的土壤样品,称取10 g土样,加入到90 mL无菌生理盐水中,30 ℃摇床中160 r/min振荡1 h。将浑浊的样品静置至澄清,吸取澄清的上清液5 mL加到100 mL富集培养基中富集2 d。然后将富集培养基进行适当的稀释,涂布于以胶体甲壳素为惟一碳源的初筛平板,放置于30 ℃恒温培养箱中培养2 d。采用透明圈法挑选透明圈直径(C)和菌落直径(H)比值(C/H)较大的菌株进行摇瓶发酵复筛,筛选出一株产甲壳素酶活性比较高的菌株,斜面(种子)培养基保藏,并进行16S rDNA鉴定。
1.2.2 诱变方法
1)一次紫外诱变。从斜面上培养好的出发菌株挑取1~2环到种子培养基,培养到对数生长期6 000 r/min离心10 min后,沉淀用无菌盐水悬浮并洗涤,3次重复后,将菌悬液加入到装有玻璃珠的250 mL的摇瓶中,30 ℃摇晃1 h。将菌悬液稀释至浓度为107~108个/mL,将7 mL菌悬液均匀涂布于各无菌平皿中,在30 W紫外灯下,距离28 cm处分别照射0、5、10、15、20、25、30、35、40、45、50 s。4 ℃放置2 h后进行适当稀释,涂布于初筛平板上,每个稀释梯度3个平行,30 ℃避光培养2 d。将诱变前后的稀释液平板计数,计算致死率。根据所得的致死曲线结果得到合适的照射时间。重复前面的操作,将菌悬液在紫外灯下照射合适的时间,进行适当倍数稀释,涂布于甲壳素酶初筛平板,在30 ℃恒温培养箱中避光培养3 d。挑取透明圈直径与菌落直径比值相对较大的菌株接种于斜面培养基,然后对所选菌株进行发酵试验和酶活测定。
2)二次紫外诱变。选取一次紫外诱变酶活最高的菌株作为出发菌株,重复一次紫外诱变操作。
3)紫外-氯化锂复合诱变。选取一次紫外诱变酶活最高的菌株作为出发菌株,以二次紫外照射中最有可能得到发生正突变的时间对菌株进行照射,之后进行适当梯度的稀释涂布于含氯化锂培养基的平板,挑取透明圈直径与菌落直径比值相对较大的菌株进行酶活测定。
1.2.3 酶活测定方法
1)Schales试剂制备:称取53 g碳酸钠,溶解于800 mL 超纯水中,加入0.5 g铁氰化钾,溶解后用去离子水定容至1 000 mL。
2)采用铁氰化钾法测定:取培养后的发酵液,以8 000 r/min离心10 min,1.0 mL发酵上清液和1 mL 10 g/L胶体甲壳素(胶体甲壳素悬浮于50 mmol/L pH 7.0的磷酸钠缓冲液)37 ℃反应1 h[12],做3份平行。然后8 000 r/min离心5 min,取1 mL上清液和4 mL的Schales 试剂沸水浴反应15 min。迅速冷却,在波长420 nm处测定吸光度。酶活定义为在37 ℃反应下,每小时释放1 μmol N-乙酰-D-氨基葡萄糖所需要的酶量为1 U。
2 结果与分析
2.1 菌株的筛选结果
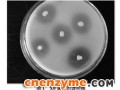
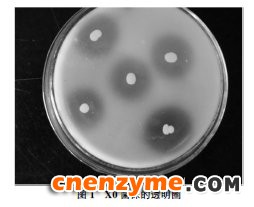
采集50多个土壤和污水样品,采用以胶体甲壳素为惟一碳源的初筛平板进行初筛,平板透明圈如图1所示,命名为X0。将所得菌株进行摇瓶发酵培养复筛,以胶体甲壳素为底物通过测定甲壳素酶活,得到一株产甲壳素酶活性较高(0.9 U/mL)的菌株,证明甲壳素酶的存在。对该菌株进行16S rDNA鉴定,初步鉴定为气单胞菌属的一种(Aeromonas sp.)。
2.2 一次紫外诱变结果
出发菌株X0经紫外线照射不同时间后,致死率如图2所示。由图2可知,紫外照射时间越长,对于菌体细胞的伤害越大,菌体的死亡率在15 s之前迅速增加,菌体细胞的存活率相应地迅速降低。从图2 可以看出当照射时间在10 s时,菌体的死亡率达到70.45%;照射时间20 s时,致死率为95.75%。根据研究报道,致死率在70%~80%时,诱变效果最好[13]。由此选择10 s作为最佳诱变时间,得到60株诱变菌株,其中有15株酶活相对较高,甲壳素酶活如表1所示。从表1可以看出,UV1-7的酶活最高,为1.33 U/mL,酶活是初筛菌株的1.48倍。
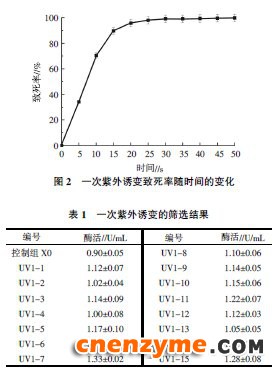 、
、
2.3 二次紫外诱变结果
选取一次紫外诱变的菌株UV1-7作为二次紫外诱变的出发菌株,对UV1-7菌株进行不同时间的照射,结果如图3所示。从图3可以看出,照射15 s时,致死率达到了78.3%;在25 s致死率达到了92.4%。出发菌株UV1-7经过紫外照射不同时间后,随着照射时间的延长,菌体的存活率明显下降。根据报道,选择致死率在70%~80%之间的照射时间作为最优照射时间[13]。所以选择照射时间15 s进行二次紫外诱变,根据C/H的不同,挑选了60株接种到斜面上,然后测定这60株菌的酶活,其中有15株菌比UV1-7产的甲壳素酶活性高。这15株菌株酶活结果如表2所示,其中菌株UV2-7产的甲壳素酶活性最高(2.84 U/mL),是初筛菌株的3.16倍。比较UV1-7和UV2-7的致死曲线,表现出不同,说明经过一次紫外诱变后,菌株的抗紫外能力略有提高。
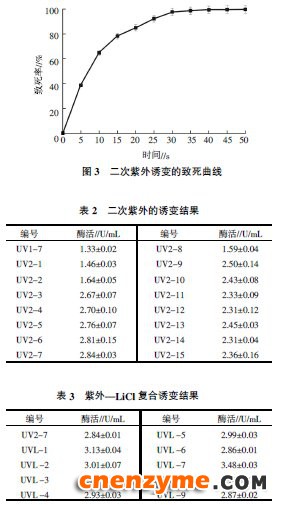
2.4 二次紫外-LiCl复合诱变结果
以一次紫外诱变酶活最高的菌株UV1-7为出发菌株,紫外时间选择二次紫外诱变的15 s。菌株经过紫外照射后,将菌液涂布于LiCl平板上。恒温培养箱中30 ℃ 培养3 d后,挑取C/H较大的30株菌,接入斜面培养基,之后进行酶活测定,其中有9株菌株产的甲壳素酶活性较高,结果如表3所示。由表3可知,UVL-7所产酶的活性最高(3.48 U/mL)。
2.5 遗传稳定性试验结果
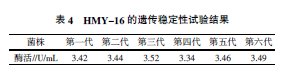
选择经过以上诱变方法得到的菌株中产甲壳素酶活最高的菌株UVL-7,进行遗传稳定性试验,结果如表4所示。由表4可知,通过对UVL-7进行产酶特性的研究,传代六次,相对于UVL-7产酶的活性,最高为1.239倍,最低为1.176倍。可知该菌株在六代内遗传稳定较好,因此选择UVL-7作为最后诱变所选菌株,命名为HMY-16。
3 小结
本试验从不同来源的土壤和废水中得到一株产甲壳素酶的菌株,对该菌株进行了一次紫外诱变,二次紫外诱变或者紫外和LiCl复合诱变。酶活分别达到了1.33、2.84和3.48 U/mL,酶活分别为初筛菌株(0.9 U/mL)的1.48,3.16和3.87倍。挑选酶活最高的菌株UVL-7进行遗传稳定性试验,传代六次,表明其在六代内酶活相对稳定,命名其为HMX-16。
教育期刊网 https://www.jyqkw.com
参考文献:
[1] 伊金玲.产甲壳素酶菌株HD002的筛选鉴定、发酵条件优化、酶的分离纯化及酶学性质研究[D].山东青岛:中国海洋大学,2010.
[2] GOODAY G W. Physiology of microbial degradation of chitin and chitosan[J]. Biodegradation, 1990,1(2-3):177-190.
[3] LIANG T W, CHEN Y Y, PAN P S, et al. Purification and chitinase/chitosanase from Bacillus cereus and discovery of an enzyme inhibitor[J]. International Journal of Biological Macromolecules, 2014, 63:8-14.
[4] 万云洋,杜予民,杨建红,等.甲壳酶特性与应用研究[J].天然产物研究与开发,2003,15(6):572-579.
[5] 韩宝芹,伊金玲,蔡文娣,等.产甲壳素酶菌株的发酵条件、酶的分离纯化及酶学性质研究[J].中国海洋大学学报(自然科学版),2010,40(10):57-62.
[6] SCHLUMBAUM A, MAUCH F, V?魻GELI U, et al. Plant chitinases are potential inhibitors of fungal growth[J]. Nature, 1986,324: 365-367.
[7] WANG S L, SHIH I L, LIANG T W, et al. Purification and characrization of two antifungal chitinases extracellularly produced by Bacillus amyloliquefaciens V656 in a shrimp and crab powder medium[J]. Agricultural and Food Chemistry, 2002, 50(8):2241-2248.
[8] MUKHERJEE G, SEN S K. Purification, characterization, and antifungal activity of chitinase from Streptomyces venezuelae P10[J]. Current Microbiology, 2006, 53(1):265-269.
[9] ESCOTT G M, HEARN V M, ADAMS D J. Inducible chitinolytic system of Aspergillus fumigatus[J]. Microbiology, 1998,144:1575-1581.
[10] 李真金,任 丹,苏文涛,等.L-乳酸高产菌选育及其发酵条件的优化[J].四川大学学报(自然科学版),2011,48(2):451-456.
[11] 邱雁临,梁 亮, 汪 亮.紫外线与氯化锂复合诱变选育L-组氨酸产生菌[J].现代食品科技,2008,24(3):217-219.
[12] SAIMA M K, ROOHI I Z. Isolation of novel chitinolytic bacteria and production optimization of extracellular chitinase[J]. Journal of Genetic Engineering and Biotechnology,2013, 11(1):39-46.
[13] 张 克,旭陈宁,张 蓓,等.代谢控制发酵[M].北京:中国轻工业出版社,1998.