解淀粉芽胞杆菌α-淀粉酶 (Bacillusamyloliquefaciensα-amylase, BAA),又被称为中温α-淀粉酶(简称:中淀),是中高温段淀粉液化的主要酶种之一[1],广泛应用于洗涤、造纸、淀粉糖、焙烤工业、啤酒酿造、织物退浆、酿造、酒精工业、有机酸工业和医药行业等[2-4],是我国工业酶制剂的重要组成成员。
BAA属于糖苷水解酶的第13家族 (glycoside hydrolase family 13,GH13)。BAA的编码基因,首先由PALVA 等于1982年通过鸟枪法在Bacillussubtilis中克隆成功[5-6],对其结构-功能相关关系研究揭示,D194N或E185K突变,可降低BAA的热稳定性[7];LEE[8]等对 BAA编码基因进行了随机突变,发现位于氨基酸残基233位置上的 Ca2+结合位点对于 BAA 的性质具有重要影响;刘洋等[9-10]对BAA中Ca2+结合位点上的氨基酸残基231、233和438 分别进行定点突变,与天然 BAA 相比,3个突变体的比酶活均有下降,突变体 D233NKm上升了 55.6%,κcat值下降了 85%,另外2个突变体的Km和κcat值与天然BAA相比没有明显的变化。另一方面,我国科研工作者运用分子克隆与遗传重组技术等[9, 11-12],对BAA工业生产菌种进行了成功改良,BAA工业菌种的发酵生产水平从早期的300 U/mL大幅提升到1 200 U/mL以上,并且显著改善了发酵工艺与产品稳定性,使我国成为世界上中温α-淀粉酶的生产国与供应国。
与相关重要淀粉液化酶特别是高温α-淀粉酶相比,有关BAA分子特性改良等研究相对滞后。通过分子进化等技术提高其催化效率,不仅有助于其工业应用,也有可能进一步提高其生产菌种的发酵生产水平。为此,本文就BAA催化效率的分子进化进行探索,为后续BAA生产菌种遗传改良奠定基础。
1.1.1 菌株和质粒
解淀粉芽胞杆菌(B.amyloliquefaciens)CICIM B2125为中温α-淀粉酶生产菌株[9],用于本研究的BAA编码基因的供体,大肠杆菌(Escherichiacoli)JM109和地衣芽胞杆菌(Bacilluslicheniformis)D402[11,13](ΔamyΔhspΔaprE)用于本研究基因克隆与表达宿主。pND-113为前期经pHY-WZX[14]改造获得,可介导外源基因在大肠杆菌和地衣芽胞杆菌等宿主细胞中分泌表达外源酶分子。pND-BAA为本研究构建重组分泌表达质粒,含有BAA编码基因。除特别说明外,所有菌株在LB培养基(酵母膏0.5%,蛋白胨1%,NaCl 1%)中,于37 ℃下培养,必要时在培养基中添加0.5%可溶性淀粉或/和添加20 μg/mL卡那霉素。
1.1.2 工具酶和试剂
限制性内切酶、连接酶、蛋白质分子量标准购自美国Thermo Fisher Scientific公司;Pyrobest、TaqDNA聚合酶、dNTPs、三磷酸核苷、MgCl2及MnCl2购自上海生工生物工程有限公司。质粒小提试剂盒及PCR产物纯化试剂盒购于美国OMEGA公司,其余化学常用试剂均为进口或国药分析纯。BAA纯品为实验室前期纯化并保存。
1. 2 方法
1.2.1 分子克隆常规操作
PCR扩增、质粒DNA和PCR产物的提取、纯化、酶切、琼脂糖凝胶电泳、连接、转化等按照实验室常规方法进行[15]。DNA序列测定采用Sanger氏的双脱氧末端链终止法进行。
1.2.2 BAA编码基因的PCR扩增
以B.amyloliquefaciensB2125基因组DNA为模板,以引物BAA-F(5′-TACGGATCCGTAAATGGCACGCTGATGCAGTAT-3′,下划线处为外加克隆位点BamHI)和BAA-R (5′-TTATTTCTGAACATAAATGGAGACGG-3′)介导目的基因扩增。PCR扩增体系50 μL模板DNA 1 μL,10×PCR 缓冲液5 μL,2.5 mmol/L dNTPs 4 μL,BAA-F 1 μL,BAA-R 1 μL,Pyrobest DNA多聚酶0.2 μL,补ddH2O至50 μL;PCR反应条件为:95 ℃ 5 min;扩增30个循环(94 ℃ 15 s,58 ℃ 30 s,72 ℃ 1 min 30 s);72 ℃,10 min。
1.2.3 易错PCR反应
易错PCR扩增体系(50 μL)为:10×PCR 缓冲液(不含Mg2+和Mn2+)5 μL,100 mmol/L dCTP 0.5 μL,100 mmol/L dTTP 0.5 μL,10 mmol/L dATP 1 μL,10 mmol/L dGTP 1 μL,Mg2+6.5 mmol/L, Mn2+0.5 mmol/L, BAA-F 1 μL,BAA-R 1 μL,BamHI线性化pND-BAA DNA 1 μL。PCR扩增在TaqDNA多聚酶介导下进行。扩增程序为:95 ℃ 5 min;扩增30个循环(94 ℃ 15 s,58 ℃ 30 s,72 ℃ 1 min 30 s);72 ℃,10 min。
1.2.4 BAA突变体库搭建与突变效率检验
将易错PCR产物纯化后,先用DpnI酶切去除模板DNA,再用BamHI酶切,然后与表达质粒pND113进行连接,连接物转化入宿主E.coliJM109,将转化子点种于96孔微孔板中,培养并保藏。随机挑取100个转化子,提取其质粒DNA,进行核苷酸序列测定,统计基因中碱基突变、突变方式及氨基酸突变等。
1.2.5 BAA突变体初筛与复筛
突变体初筛:在筛选平板(含有0.5%淀粉的LB平板)点种转化子并以E.coliJM109 (pND-BAA)为对照,相同培养条件下培养16~24 h后,目测淀粉水解圈大小,挑取透明圈明显增大者保藏及进一步实验。
将初筛得到的透明圈增大的转化子和对照JM109 (pND-BAA),1株3瓶接种于LB液体培养基中,37 ℃,200 r/min,振荡培养12 h后,以10%(v/v)的接种量转接于发酵培养基(在LB培养基的基础上添加2%乳糖),37 ℃,200 r/min,振荡培养36 h后,将各菌株培养液10 000 r/min 4 ℃离心15 min,收集上清液,并测定淀粉酶酶活力。其质粒DNA经分离纯化后进行核苷酸序列测定与分析。
1.2.6 BAA突变体的制备与纯化
地衣芽胞杆菌的遗传转化按文献方法进行[14]。将上述获得的BAA突变体表达质粒转化入地衣芽胞杆菌D402,在含20 μg/mL卡那霉素的LB平板上于37 ℃培养2~3 d,筛选出转化子。转化子接种于LB液体培养基,37 ℃,200 r/min 培养12~14 h作为种子,以10%(v/v)的接种量接于摇瓶发酵培养基中(在LB培养基的基础上添加2%乳糖),在37 ℃,220 r/min 条件下发酵培养120 h,发酵结束后,离心收集上清液,即为BAA突变体粗酶液。酶液纯化用AKTA pure system H8(29-2827-26型,GE Healthcare 公司)进行。蛋白质纯度用SDS-PAGE进行分析[15],蛋白质浓度按照Bradford的蛋白质微量测定方法进行。
1.2.7 酶活测定
用DNS法[10]。酶活力单位定义为:1 mL稀释酶液在pH 6.0、60 ℃条件下,1 h水解1.0 %可溶性淀粉产生相当于1 mg葡萄糖还原力,定义为1个酶活力。
1.2.8 酶学性质与特征分析
1.2.8.1 最适反应温度和温度稳定性
在不同温度下(30~90 ℃)测定的淀粉酶活力,以测得的最高酶活力为100%,计算其他温度下的相对酶活力,确定最适反应温度;在反应体系中添加或不添加5 mmol/L Ca2+,将其置于60 ℃或70 ℃水浴中,保温60 min,每隔15 min取样,冰浴30 min后,用1.2.7的方法在最适温度下测定处理后酶液的残余酶活力,以未进行热处理的酶液酶活力为100%,计算相对酶活,以确定酶的热稳定性。
1.2.8.2 最适反应pH和pH稳定性
在60 ℃条件下,分别测定不同pH缓冲溶液下的酶活力,以测得的最高酶活力值为100%,计算其他pH条件下的相对酶活力,确定最适反应pH。将酶液置于不同pH值的缓冲液于37 ℃保温1 h,然后用1.2.7的方法测定酶液的残余酶活力,以确定酶的pH稳定性。
1.2.8.3 不同金属离子及化学试剂对酶活力的影响
在酶的最适反应pH和最适反应温度条件下,研究金属离子和化学试剂(Na+、Ca2+、K+、Co+、Li+、Mg2+、Fe3+、Mn2+、Zn2+、EDTA、SDS)对酶活性的影响,以相同条件下未加金属离子和化学试剂的酶反应为对照。
1.2.8.4 酶的动力学参数测定
配制不同浓度的可溶性淀粉溶液为底物,在pH 6.0,温度60 ℃条件下,反应10 min,采用DNS法测定酶活力,计算酶促反应速度,测定酶的动力学参数。
1.2.9 生物信息学分析
核苷酸序列与氨基酸序列分析采用DNAMAN 5.0软件进行,BAA及其突变体的3D结构模拟采用SWISS-MODEL在线软件进行分析(https://swissmodel.expasy.org/)。
2 结果与讨论 2. 1 BAA编码基因的克隆、 表达与突变体库的搭建
以B.amyloliquefaciensB2125基因组DNA为模板,克隆出大小约1.4 kb、编码BAA成熟肽的编码基因amyQ[9-10],将其克隆入表达质粒pND-113,获得重组表达质粒pND-BAA,此质粒能够在E.coliJM109中分泌表达BAA,在淀粉平板上可形成典型的淀粉水解透明圈。
以BamHI线性化的pND-BAA为模板,进行易错PCR扩增,扩增产物经纯化与酶切后克隆入表达质粒pND-113并转化入E.coliJM109,点种转化子于含200 μL培养基的96孔微孔培养板中,继续培养13~15 h,分装与保藏,由此搭建出库容为2×104个转化子的BAA突变库。随机挑取其中100个转化子进行分析,有99个转化子含有重组质粒,其中有56个转化子的BAA编码基因发生了突变,包括26.8%发生单点突,14.3%发生双位点突变,57.1%发生多位点突变,1.8%发生无义突变,1 kb基因平均有2.8个碱基发生突变,同义突变率占73.2%,非同义突变率占26.8%,基本满足筛选需要。
2. 2 BAA酶活提高突变体的筛选
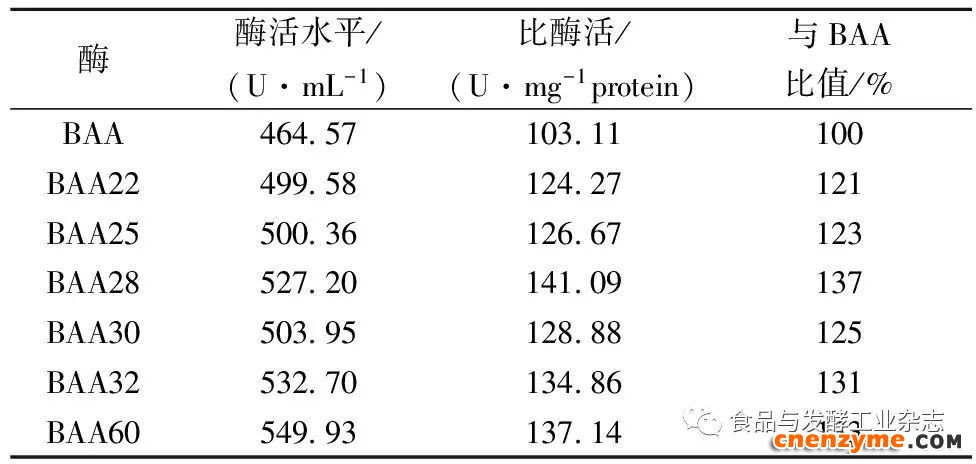
在含有可溶性淀粉的筛选平板上,通过目测透明圈大小对BAA突变体进行初筛,共筛选得到68株透明圈大于对照的转化子,占比0.68%。进一步通过摇瓶发酵进行复筛,最终筛选得到6株酶活力高于对照的突变体,以其中的突变体BAA28酶活力提高最高,是BAA的1.37倍(表1),以此作为后续进一步研究对象。
表1BAA突变体复筛
Table1ThesecondaryscreeningresultsofBAAmutants
2. 3 BAA28突变体序列分析
对BAA28突变体的编码基因进行序列测定与分析,其分子共发生了有7个碱基突变(G513A、T627C、A1021C、CG1044TT、A1066C、C1085T)并引起4个氨基酸残基 (T341P、P348L、T356P、P362L) 发生变化。从一级结构看,BAA28的4个氨基酸突变位点均位于(β/α)8桶状结构处,即α-淀粉酶家族中的催化区域,由203-392 aa折叠形成[16];从二级结构看,BAA28的突变位点T341P和T356P位于无规卷曲结构中,P348L位于α-螺旋结构中,而P362L位于β-折叠的结构中[16];从三级结构看,各突变酶的三维结构和BAA相比,没有发现明显的差异[16]。
2. 4 BAA28酶学特征
将重组质粒pND-BAA28转化入B.licheniformisD402,获得重组菌D402(pND-BAA28),通过摇瓶发酵制备酶液,经纯化,在SDS-PAGE上呈现单一条带,大小约58 kDa(图1)。可以用于后续酶学特征分析。采用B.amyloliquefacientsM2125发酵制备BAA酶液并纯化(图1),用于后续研究对照。
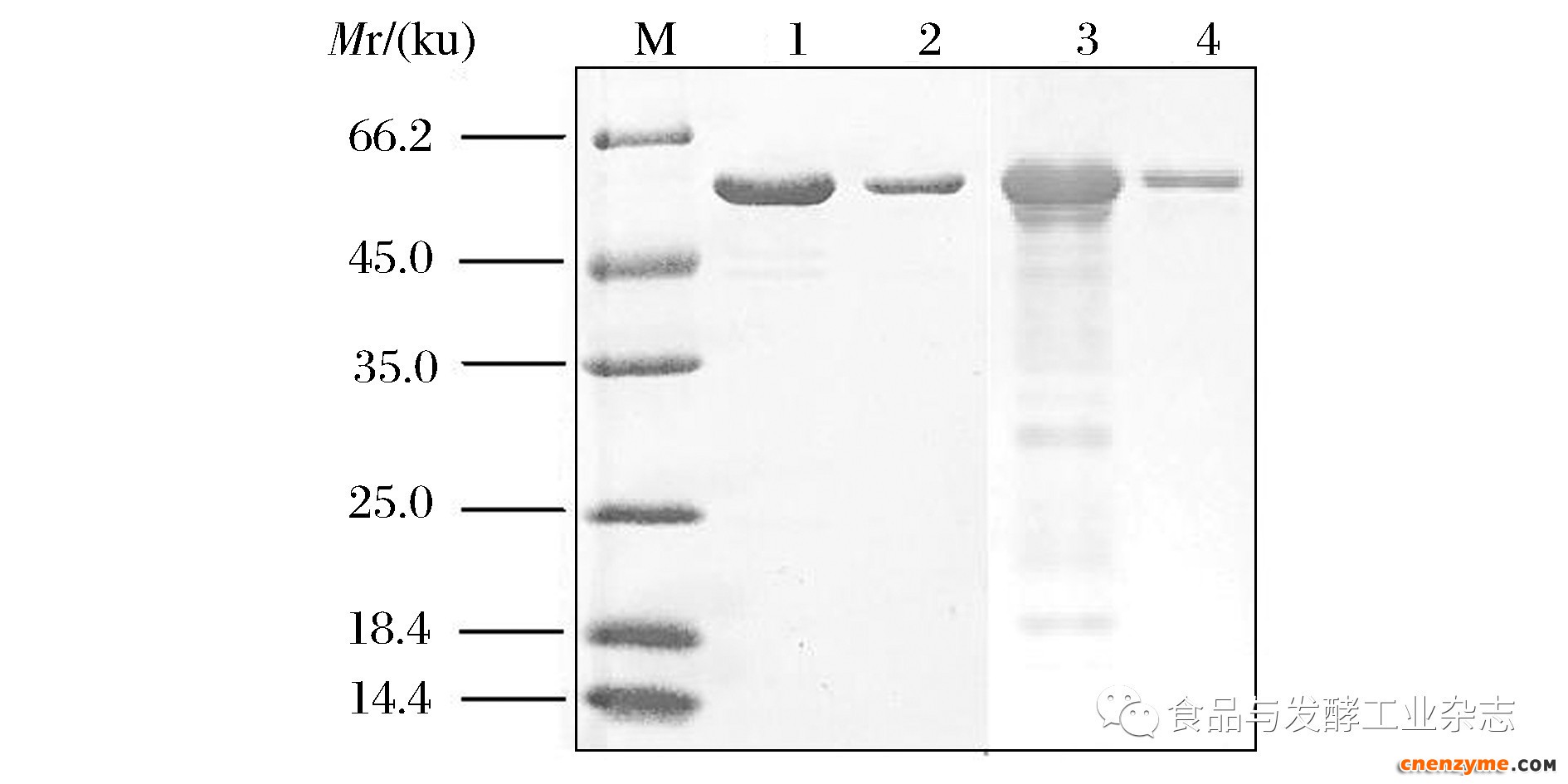
M-相对分子质量标准;1-BAA28粗酶液;2-纯化后的BAA28;3-BAA发酵液;4-纯化后的BAA
图1 BAA28纯化后的SDS-PAGE分析
Fig.1 SDS-PAGE profile of the purified BAA28
2.4.1 最适作用温度和最适作用pH
将BAA28置于不同温度或不同pH条件下测定其酶活力,BAA28的最适反应温度为60 ℃,最适作用pH为6.0;在50~70 ℃或pH5~8下皆具有较高活力。此特性与BAA基本保持一致(图2)。
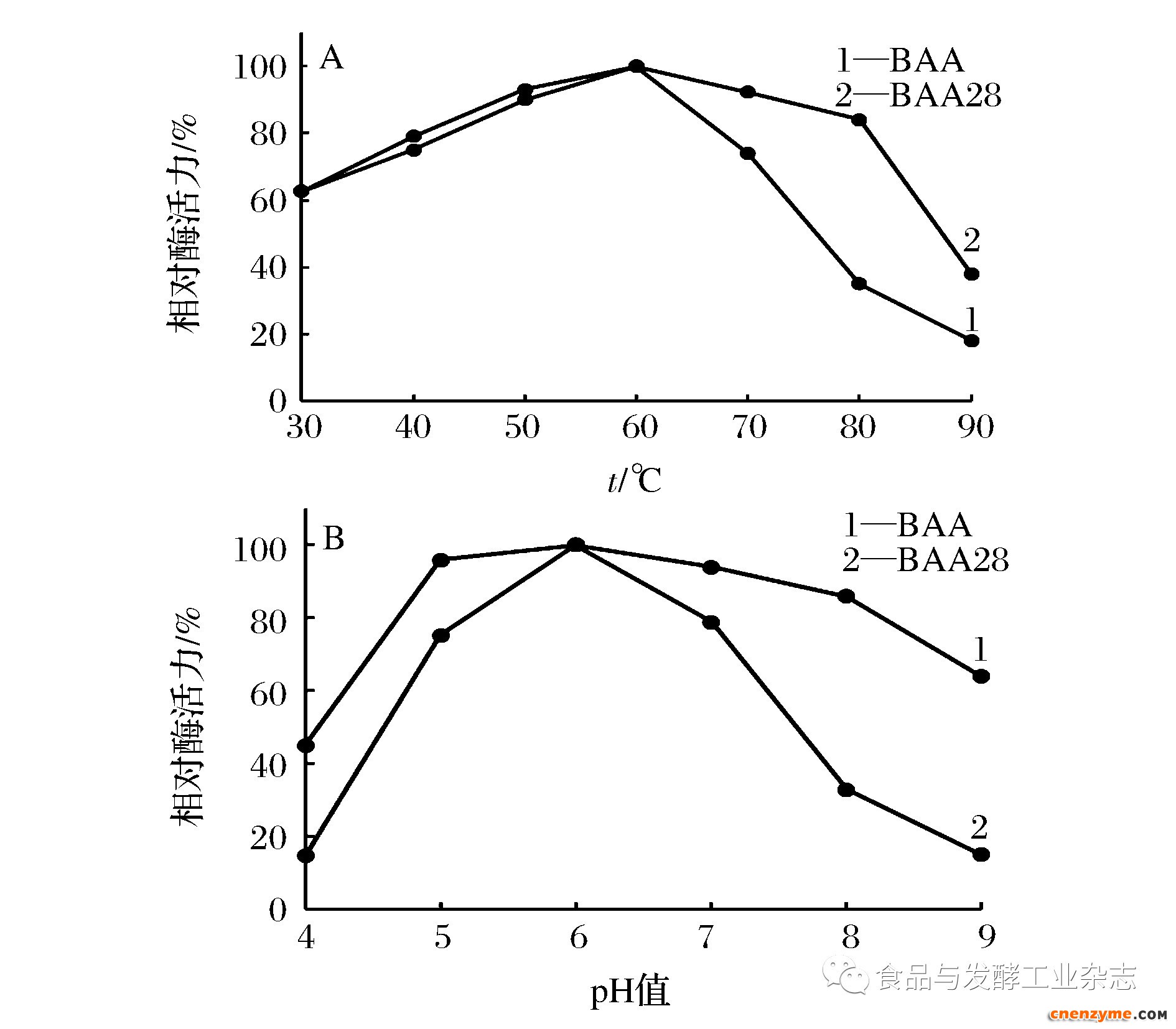
图2 BAA28的最适作用温度(A)与最适作用pH(B)
Fig.2 Temperature (A) and pH (B)optima of BAA28
2.4.2 热稳定性与pH稳定性
2+,并在不同温度(60 ℃,70 ℃)或不同pH下保温,然后按照标准酶法测定条件进行残余酶活的测定,结果汇总于图3。可见,BAA28的热稳定性明显优于BAA。BAA28的pH稳定性则与BAA基本一致,即没有发生显著改变(数据未呈现)。
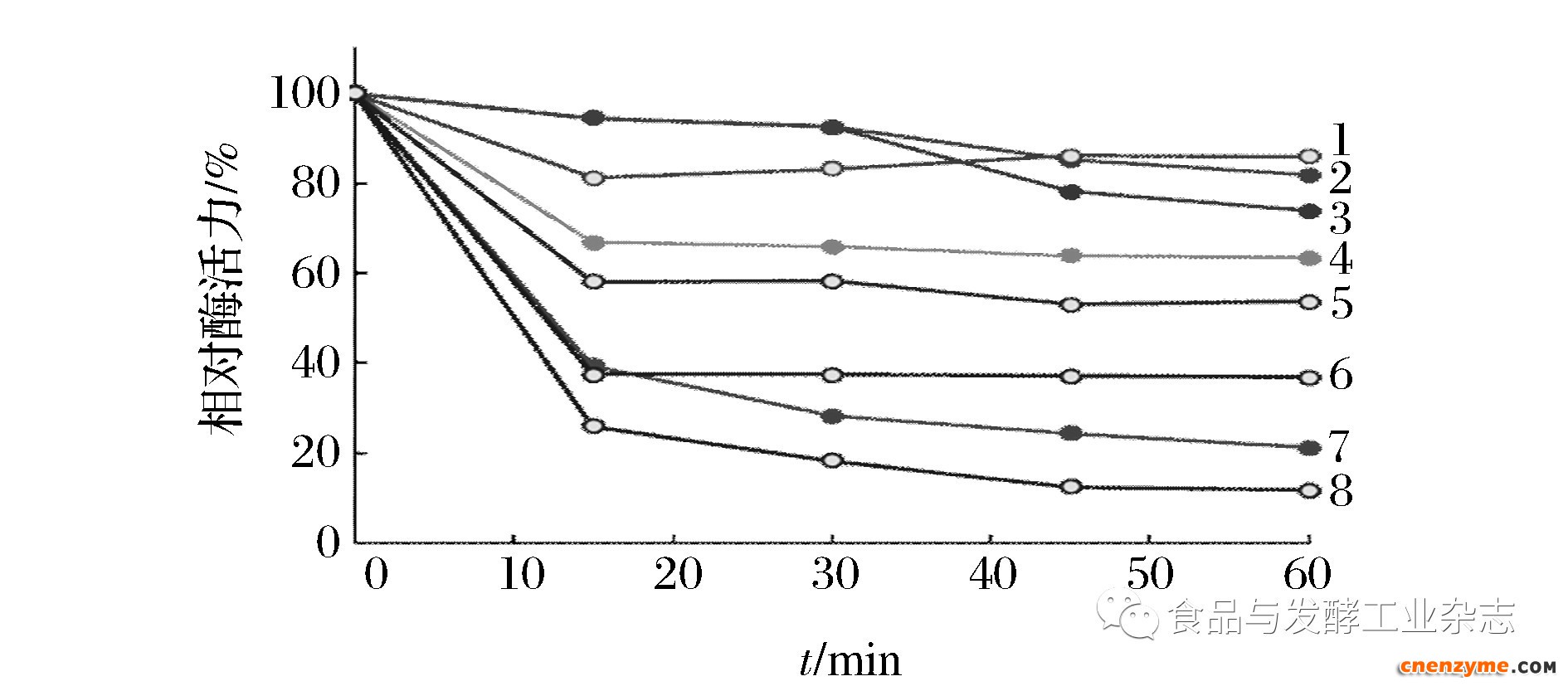
1-BAA,60 ℃,5 mmol/L Ca2+;2-BAA28,60 ℃, 5 mmol/L Ca2+; 3-BAA 28,60 ℃;4-BAA28,70 ℃,5 mmol/L Ca2+;5-BAA,60 ℃; 6-BAA,70 ℃,5 mmol/L Ca2+;7-BAA28,70 ℃;8-BAA,70 ℃
图3 BAA28的热稳定性
Fig.3 Effects of temperature on activities of BAA28
2.4.3 金属离子及化学试剂对酶活性的影响
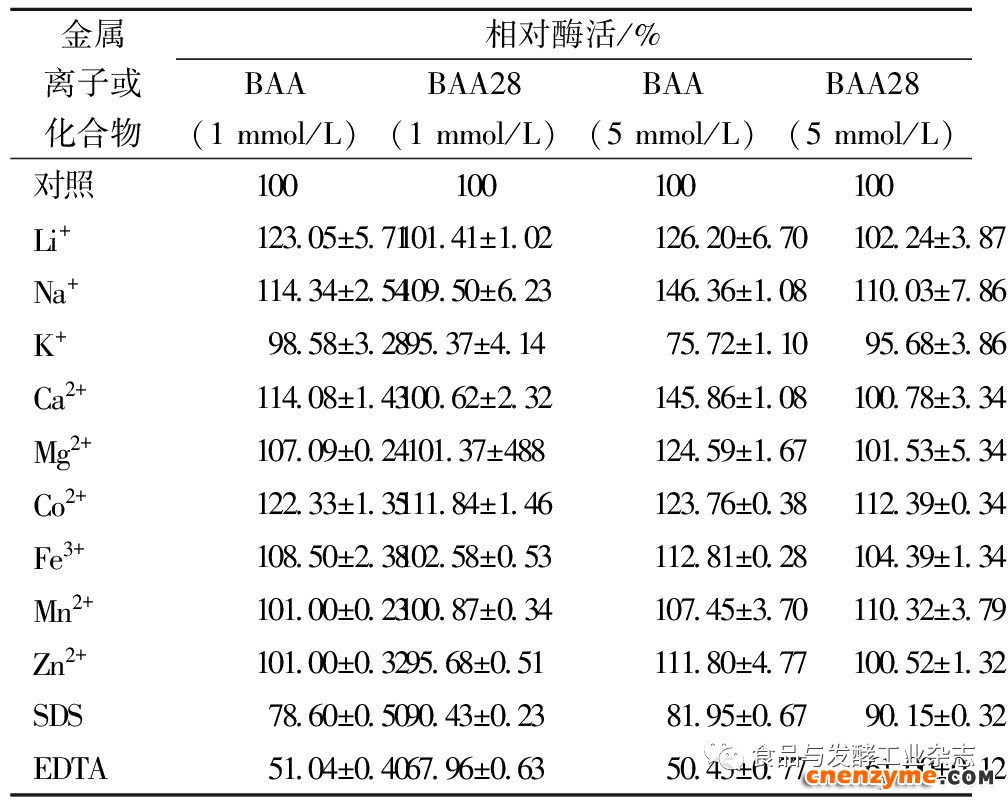
不同金属离子及化学试剂对酶活性的影响见表2。BAA28酶活几乎不依赖Li+、Ca2+、Na+或Co2+,但此4种金属离子对BAA酶活有显著促进作用。可见BAA28中发生的组合突变,引起了对金属离子依赖性的巨大变化。而这一变化明显有利于此突变体的后续工业应用,因为长期以来BAA的Ca2+依赖性,是其工业应用属性中不利的一面[10]。
表2不同离子和化学试剂对BAA28酶活力的影响
Table2EffectsofdifferentmetalionsandchemicalsonBAA28
2.4.4 BAA28动力学特征
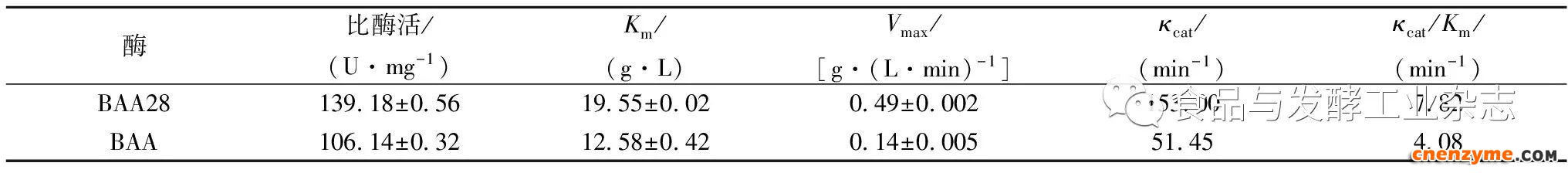
对BAA28进行比酶活测定与酶促反应动力学特征进行分析,结果汇总于表3。与BAA相比,BAA28的比酶活提高约31%,Vmax和κcat分别提高了2.5倍和1.97倍,κcat/Km值提高92%,即突变酶BAA28的催化效率提高了92%。
3 结论
综上所述,本研究通过分子进化与筛选,获得了催化属性显著改进的BAA突变体,进一步对突变体BAA28进行了较深入的研究与分析,与BAA相比,其比酶活、催化效率等皆有大幅度提升,对金属离子的依赖性也发生了显著变化。这些改进有助于后续高产菌种的构建及其工业应用。
表3BAA28的酶促动力学特征
Table3KineticparametersofBAA28
参考文献
[1] SIVARAMAKRISHNAN S,GANGADHARAN D,NAMPOOTHIRI′K M, et al. α-Amylases from microbial sources[J]. Food Tech Biotechnol, 2006, 44(2): 173-184.
[2] 姜锡瑞. 酶制剂应用手册[M]. 北京: 中国轻工出版社, 1999:33-66.
[3] van derMAAREL MJ, van der VEEN B, UITDEHAAG JC, et al. Properties and applications of starch-converting enzymes of the alpha-amylase family[J]. J Biotechnol, 2002, 94(2):137-155.
[4] TOMASIK P, HORTON D. Enzymatic conversions of starch[J]. Adv Carbohydr Chem Biochem, 2012, 68:59-436.
[5] PALVA I, PETTERSSON R F, KALKKINEN N, et al. Nucleotide sequence of the promoter and NH2-terminal signal peptide region of the ALPHA-amylase gene fromBacillusamyloliquefaciens[J]. Gene, 1981, 15(1): 43-51.
[6] PALVA I. Molecular cloning of alpha-amylase gene fromBacillusamyloliquefaciensand its expression inB.subtilis[J]. Gene, 1982, 19(1): 81-87
[7] SMIRNOVA NA, SOROKIN AV, IOMANTAS Iu V, et al. Mutations in the alpha-amylase gene ofBacillusamyloliquefaciens, leading to a decrease in the temperature of protein inactivation[J]. Mol Biol (Mosk), 1988, 22(5): 1 257-1 264.
[8] LEE S, MOURI Y, MINODA M, et al. Comparison of the wild-type alpha-amylase and its variant enzymes inBacillusamyloliquefaciensin activity and thermal stability, and insights into engineering the thermal stability ofBacillusalpha-amylase[J]. J Biochem, 2006, 139(6): 1 007-1 015.
[9] 刘洋. 中温α-淀粉酶编码基因剂量对其生产水平提高的重要作用[D]. 无锡: 江南大学, 2009.
[10] LIU Yang, SHEN Wei, SHI Gui-yang, et al. Role of the calcium-binding residues Asp231, Asp233, and Asp438 in alpha-amylase ofBacillusamyloliquefaciensas revealed by mutational analysis[J]. Curr Microbiol, 2010, 60(3):162-166.
[11] 范如意. 基因工程技术改造地衣芽孢杆菌实现中温α-淀粉酶高效表达[D]. 无锡: 江南大学, 2014.
[12] 范如意, 牛丹丹, 应喜娟, 等. 中温α-淀粉酶在地衣芽孢杆菌中的异源表达[J]. 工业微生物, 2015, 45(2): 47-54.
[13] NIU Dan-dan, ZUO Zhi-rui, SHI Gui-yang, et al. High yield recombinant thermostable α-amylase production using an improvedBacilluslicheniformissystem[J]. Microbial Cell Factories, 2009, 8:58e1-7
[14] NIU Dan-dan, WANG Zheng-xiang. Development of a pair of bifunctional expression vectors forEscherichiacoliandBacilluslicheniformis[J]. J Ind Microbiol Biotechnol, 2007, 34(5): 357-362.
[15] 诸葛健, 王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社, 1994.
[16] FITTER J, HABER-POHLMEIER S. Structural stability and unfolding properties of thermostable bacterial alpha-amylases: a comparative study of homologous enzymes[J]. Biochem, 2004, 43(30):9 589-9 599.
Construction and properties of Bacillusamyloliquefaciensα- amylasemutant of improved catalytic efficiency
NIU Dan-dan1, JIN Xiao1, WU Hai-yang2,LIU Xiao-guang2, LIN Juan1, YE Xiu-yun1*
1(College of Biological Science and Engineering, The Key Laboratory of Marine Enzyme Engineering of Fujian Province, Fuzhou University, Fuzhou 350116,China)2(College of Biotechnology, Tianjin University of Science and Technology, Tiqnjin 300457,China)
ABSTRACTBacillusamyloliquefaciensα-amylase (BAA) is one of the most widely used industrial enzymes in the starch processing, food, brewing, fermentation, textile, papermaking, and medical industries. To further enhance fermentation level and application property, the mutant with significantly improved catalytic properties was constructed viainvitromolecular evolution and its nature was preliminarily illustrated. The BAA mutation library, with the mutational frequency of 56%, the efficiency of mutation of 2.8 points/kb DNA, and the missense mutation rate of 26.8%, was constructed with the capacity of 2×104transformants by using error-prone PCR. The BAA mutants with enzymatic activity were screened using halo-plate assay and shaking flask fermentation test. Six mutants with improved activity were selected out and one of which, mutant BAA28, displayed 37% increased activity. Sequencing results illustrated that mutant BAA28 had four separated mutations: T341P, P348L, T356P, and P362L and of which, T341P and T356P were in the random coil structure, P348L was in the-helix structure, and P362L was in the-fold structure. The BAA28 was further heterologously prepared and purified and its biochemical properties were examined in comparison to wild BAA. BAA28 displayed a remarkable change in ion-dependence and thermostability. Its specific activity was significantly increased with 1.31 folds of BAA andκcat/Kmwas increased by 92%. BAA28 mutant performed significantly improved catalysis and application properties in comparison to BAA, which is of potential application in BAA-overproducing strain improvement and industrial properties.
Key wordsBacterial α-amylase; mutant; catalysis efficiency
DOI:10.13995/j.cnki.11-1802/ts.014866
第一作者:工学博士(叶秀云教授为通讯作者,E-mail:xiuyunye@fzu.edu.cn)。
基金项目:国家高技术研究发展计划(863计划)(2013AA102101);福建省教育厅产学研项目(JA15049);国家自然科学基金(31601407);福建省自然科学基金(2016J01157)
收稿日期:2017-06-01,改回日期:2017-06-21