果胶质广泛存在于高等植物中,是植物细胞胞间层和初生壁的重要组成成分,植物的细胞组织间起"黏合"作用。近几年来,果胶质的生物降解日益引起国内外学者的广泛关注。能够分解果胶质的酶被称作果胶酶(pectinase),它广泛存在于各种微生物中,细菌、真菌和放线菌都能产生相关酶类。果胶酶类的应用领域非常广泛,不仅可用于食品工业如水果加工及葡萄酒生产等方面,还广泛应用于麻类脱胶、木材防腐、生物制浆、环境保护、污物软化处理和饲料等行业中。果胶酶主要分为原果胶酶、聚半乳糖醛酸酶、裂解酶和果胶酯酶等几大类,研究果胶酶各组分的性质,有利于果胶酶的单一酶种的开发利用。同时微生物果胶酶的分子生物学研究将有助于更合理地利用果胶酶。
1、 果胶简介
果胶分子是由不同酯化度的半乳糖醛酸以α-1,4糖苷键聚合而成的多糖链,常带有鼠李糖、阿拉伯糖、半乳糖、木糖、海藻糖、芹菜糖等组成的侧链,游离的羧基部分或全部与钙、钾、钠离子,特别是与硼化合物结合在一起[1]。它存在于所有的高等植物中,沉积于初生细胞壁和细胞间层,在初生壁中与不同含量的纤维素、半纤维素、木质素的微纤丝以及某些伸展蛋白(extensin)[2]相互交联,使各种细胞组织结构坚硬,表现出固有的形态.果胶分子的结构因植物的种类、组织部位、生长条件等的不同而不同,其大致的结构简图如图1所示,总体可分为光滑区(smooth region)和须状区(hairy region)两部分,主要由HGA、RG-I和RG-II三个结构区域构成,其中RG-II常以二聚体的形式存在.同其它植物多糖一样,果胶也是多分子的、多分散的、多结构的、有高级空间构象的,也具有一定的相对分子质量分布。
2、果胶酶分类
从广义上讲,果胶酶可以被分为3种类型:①原果胶酶:可以把不溶于水的原果胶分解为可溶于水的高聚合体果胶;②果胶酯酶:脱去果胶中的甲氧基基团,促使果胶的脱甲酯作用;③解聚酶:促使果胶中D-半乳糖醛酸的α-1,4糖苷键的裂解。近来人们提出了更详细分类方法为[3]:原果胶酶(protopectinases)、多聚半乳糖醛酸酶(Polygalacturonases)、裂解酶(pectin lyases, PL)、果胶酯酶(Pectinesterase, PE)。
2.1 原果胶酶
Briton等人[4]把能够促使原果胶溶解的酶命名为原果胶酶。根据其作用机理分为两种类型:A型原果胶酶与B型原果胶酶。前者主要作用于原果胶的内部的多聚半乳糖醛酸区域。而后者主要作用于外部的连接聚半乳糖醛酸链和细胞壁组分的多糖链。
2.2 多聚半乳糖醛酸酶(Polygalacturonases)
聚半乳糖醛酸酶是在有水环境下促进聚半乳糖醛酸链水解的一种果胶酶,应用最为广泛。根据水解作用机理不同,它可以分为内切聚半乳糖醛酸酶 (E.C.3.2.1.15)和外切聚半乳糖醛酸酶(E.C.3.2.1.67)。外切酶又可以划分两种类型:一种是真菌外切聚半乳糖醛酸酶,它的终产物是单体半乳糖醛酸;另一种是细菌外切聚半乳糖醛酸酶,它的终产物是二聚体的半乳糖醛酸。
2.3 裂解酶(pectin lyases,PL)
裂解酶(反式消去酶)是通过反式消去作用裂解果胶聚合体的一种果胶酶,裂解酶在C-4位置上断开糖苷键,同时从C-5处消去一个H原子从而产生一个不饱和产物。根据其作用机理以及作用底物的不同,裂解酶可以划分为:① 内切聚半乳糖醛酸裂解酶(EndoPGL,E.C.4.2.2.2);② 外切聚半乳糖醛酸裂解酶(ExoPGL,E.C.4.2.2.9);③内切聚甲基半乳糖醛酸裂解酶(EndoPMGL,E.C.4.2.2.10);④外切聚甲基半乳糖醛酸裂解酶(ExoPMGL)。
3、 果胶酶产生菌
目前国内外研究和应用较多的果胶酶产生菌是细菌和霉菌[5, 6],也有链霉菌产生果胶酶的报道[7]。在细菌中,欧文氏杆菌(Erwinia sp.)、芽孢杆菌(Bacillus sp.)、节杆菌 (Arthrobacter sp.)和假单胞杆菌(Pseodomonas sp.)都产生果胶酶。嗜碱性芽孢杆菌属和欧文氏杆菌属主要用于在苎麻和红麻的脱胶、生物制浆及污物的处理软化等方面,应用前景可观,受到较多的关注和研究。已见报道的产果胶酶的霉菌种类大约包括20个属, 如曲霉属(Aspergillus sp.)、灰霉菌属(Botrytis sp.)、镰孢菌属(Fusarium sp.)、炭疽菌属(Colletotrichum sp.)、核盘菌属(Scletorium sp.)和玉圆斑菌属(Cochliobolus sp.)等。目前,黑曲霉、根霉和盾壳霉作为产果胶酶的菌株已经商品化。国内外对霉菌发酵产果胶酶的研究主要集中在曲霉属中,而曲霉属中研究最多的是黑曲霉。其原因是,果胶酶被广泛应用于食品工业中,如用于果汁、果酒及中药营养液的深加工等,使得产品质量和外观得以改善,而生产食品酶制剂的菌株必须是安全菌株。黑曲霉分泌的胞外酶系较全,不仅可以产生大量果胶酶,而且黑曲霉属于安全菌株。另外,黑曲霉产生的果胶酶最适pH值一般在酸性范围内,这也是其被应用于食品工业行业中的原因之一。
A型原果胶酶主要来源于酵母及酵母状真菌的发酵液中。研究人员已经从Kluyveromy cesfragilis IFO0288. Galactomyces reesei L.和Trichosporon penicilla- tum SNO 3[8]中分离出了原果胶酶.依次称为原果胶酶-F,-L和-S(PPase-F.-L.-S),另外从Bacillus subtilis IFO12113,B.subtilis IFO3134和Tramete sp.菌株中分离出了B-型原果胶酶[8],依次称为原果胶酶-B,-C和-T(PPase-B,-C和-T)。
内切聚半乳糖醛酸酶广泛分布于真菌和细菌中,在一些高等植物和寄生于植物的线虫中我们也发现了此种酶。据报道,现在已经在许多微生物的菌体中发现了这种内切酶,包括Aureobasidium pullulans,Rhizoctoniasolani Kuhn,Fusarium moniliforme,Neurospora crassa,Rhizopus stolonifer,Aspergillus sp,Thermomyces lanuginosus,Peacilomyces clavisporus等。科研人员已经在大量的微生物种类中,对内切聚半乳糖醛酸酶进行了克隆复制,在遗传学方面进行了大量的研究。相对而言,产生外切聚半乳糖醛酸酶的微生物较少。已经报道的产生外切活性酶的微生物有:Erwiniacarotovora,Agrobacterium tumefaciens,Bacteroides thetaiotamicron,E.chrysanthemi,Altemaria mali,Fusarium oxysporum,Ralstonia solanacearum,Bacillus sp.等[9-11] 。
聚半乳糖醛酸裂解酶(PGLs)可以由多种细菌和一些致病性的真菌产生,内切聚半乳糖醛酸裂解酶比外切聚半乳糖醛酸裂解酶要丰富。可以从腐烂食物中的细菌和真菌中分离到PGLs。据报道,从Colletotrichum lindemuthionum,Bacteroides thetaiotaomicron,Erwinia cartovora,A mucala sp,Pseudomonas syringae pv.Glycinea, Colletotrichummagna,E.chrysanthemi,Bacillus sp,Bacillus sp.DT-7,C. gloeosporioides等[12,13]
菌株中可以分离到此种酶。相比之下关于聚甲基半乳糖醛酸裂解酶(PMGLs)的产品却鲜于报道,仅有少数报道指出我们可以从As. pergillusjaponicus,Penicillium paxilli,Penicillium sp.,Pythium splendens ,Pichia pinus,Aspergillus sp.,Thermoascusauratniacus中分离到此种酶[13-16]。
3、果胶酶的理化性质
3.1 果胶酶活力检测方法
掌握可靠的酶分析定量方法是开展果胶酶研究工作的重要前提。果胶酶的测定方法很多,各具特点,且酶活单位的定义不同,要根据不同情况加以选择对比。常用的酶活力测定方法有[17]:
3.1.1 滴定法
滴定法主要用于测定果胶酯酶的活力,根据该酶作用机制,采用滴定羧基来评价酶活。果胶酯酶的活力还有一种测定方法,即,通过气相色谱或液相色谱仪定量分析甲醇,根据甲醇的生成量来评价酶活,此方法比较精确但要求较高。
3.1.2 黏度下降法
黏度下降法基于果胶物质在酶的作用下大分子降解伴随底物溶液黏度下降这一事实,以底物黏度下降的百分比来评价酶活。该方法所测定的酶活性,主要是反映内切酶酶活。
3.1.3 脱胶作用时间法
该方法根据果胶物质在未被酶解之前以及在酶解反应的不同时期能在异丙醇溶剂中形成大小不等的胶团而判断酶的活性。该方法最能反映内切水解酶和内切裂解酶两种酶在实验条件下的综合能力。
3.1.4 还原糖测定法
无论是内切还是外切果胶酶的作用,长链果胶分子的糖苷键断裂结果都产生还原端基。这些还原端基的生成量。可用来表示酶活性。最为常用的为DNS(3,5-二硝基水杨酸)法。
3.1.5 235nm处紫外吸收测定法
这是专门测定裂解酶活力的一种方法。裂解酶作用于底物经历一个β-消除反应,使底物生成非还原末端C4、C5 之间带有双键的产物,该产物在235nm处产生最大紫外吸收,酶活性测定正是根据该反应产物而设计的。
3.2 微生物果胶酶的酶学性质
国内外科学家利用层析、电泳等手段对果胶酶的酶学性质进行了研究,明确了一些果胶酶的分子量、动力学性质及其影响因素。常用果胶酶纯化方法有:硫酸铵沉淀、丙酮沉淀、离子交换层析以及凝胶过滤色谱等。果胶酶分子量一般在20kD~60kD之间,单体存在,个别以多聚体形式存在,如海栖热袍菌果胶酸裂解酶分子量为115.2kD,结构为四聚体。通常果胶酶活性范围在pH3.0~9.0,等电点pH4.0~9.0。其中,最适pH4.0~6.5的为水解酶,其作用不需要Ca2+参与。而裂解酶的作用需要Ca2+参与,最适pH为8.0~10.0。不同菌种所产果胶酶性质有所不同。Alana等人[18]采用了半固体和液体发酵两种不同的培养方式,采取凝胶过滤色谱和层析聚焦两种生化手段对Penicillium italicum生产果胶酶进行研究,发现两种培养方式产生的酶分子量、等电点、Km都相同,分别为22kD、8.6、3.2mg/ml。最适作用温度 50℃,最适pH6.0~7.0,远低于细菌果胶裂解酶最适pH,Co2+、Cu2+、Fe2+ 是其抑制剂。不同的是:该菌株液体发酵分泌果胶裂解酶可在低pH条件下由高酯果胶诱导。半固体发酵产生的果胶裂解酶活力高,专一性较差。Bruhlmann F[19]对无枝酸菌果胶裂解酶进行了纯化鉴定。该酶分子量为31kD,最适pH为l0.25,等电点为10.0,在pH6.0~8.0内酶活稳定,Ca2+是其保持活性的必需离子。并对该酶降解果胶的产物进行了研究,先通过体积排阻色谱分离果胶酶降解产物,然后由快原子轰击电离质谱确定其组分,结果显示酶解反应初期就产生了大量的不饱和寡半乳糖醛酸,证明了该酶是内切酶。Saccharomyces eerevisiae的基因PGL1-1 编码的聚半乳糖醛酸酶,分子量42kD,最适作用温度25℃,最适作用pH4.0,在pH3.0~5.0内酶活稳定,pH3.0时酶活保留80%,耐酸能力极强[20]。
其它微生物果胶酶的生化特性见表1[21,22]。
4、果胶酶的生物学研究
4.1 果胶酶的理化性质
果胶酶是作用于果胶质的一类酶的总称,主要功能是通过裂解或β消去作用切断果胶质中的糖苷键,使果胶质裂解为多聚半乳糖醛酸。真菌分解果胶类物质的酶主要是耐酸的多聚半乳糖醛酸酶和耐碱的果胶裂解酶,以内切型(endo-)为主,也有外切型(exdo-)。一些真菌也产生果胶酯酶和鼠李半乳糖醛酸酶(RHG)等。PG作用的最适pH值一般低于 6,大部分PG最适作用温度为45℃,相对分子质量(Mτ)为30 000~50 000,其前体蛋白一般包含360~390个氨基酸残基,基中N端信号肽为17~40个残基。PL一般作用的最适pH 值大于9,最适作用温度在55℃左右,其前体蛋白一般为370-380个残基,但有的低于250个残基,有的无N端信号肽。已报道的PE前体蛋白为331 个残基[23-25]。
真菌果胶酶一般有糖基化位点,功能酶以糖蛋白形式存在。如串珠镰孢(Fusarium moniliforme)的endo-PG前体有4个糖基化位点;玉米圆斑病菌(Cochliobolus carbonum)的PGX1 N端有12个残基的糖基化位点,糖蛋白Mτ为60 000。对24种曲霉PG的分析表明,一个内藏的Tyr残基与酶催化作用关系密切,在pH l0.5时离子化;一个外露的Tyr残基在pH9.3~9.5时离子化,可能与酶催化有关。串珠镰孢endo-PG的His234对酶活性和浸解活性起关键作用,与结合PG1P无关,当His234→Lys时无酶活,Ser237和Ser240→Gly时,酶活性分别降低48%和6%[23-27]。纤维素结合域(CBD)在纤维素酶和木聚糖酶中广泛存在,但在果胶酶中不常见。目前发现一种来自胶孢炭疽菌(Colletotrichum gloeosporioides)的果胶酶含有CBD,这是迄今发现的第一种含有CBD的果胶酶。
细菌产生的果胶酶的Mτ为10 000~80 000, 最适作用pH值一般中性偏碱,最适作用温度一般为60℃左右。菊欧文氏杆菌(Erwinia chrysanthemi)产生8种果胶裂解酶的同工酶,但其中的PELI 更易作用于部分甲酯化的果胶,在最适碱性pH值和Ca+2存在的条件下,还具有内切活性。菊欧文氏杆菌分泌果胶乙酰酯酶,Mτ为34 9OO,前体蛋白含322个残基,N端有21个残基的信号肽。
酵母中只有很少一部分株系产生果胶酶,酿酒酵母(Saccharomy cescerevisiae)endo-PG 的前体蛋白含360~380个残基,基中N端从1-18残基为信号肽序列,381~388残基的位置有糖基化位点,His222为酶的活性区域。马克斯克鲁维酵母(Kluyveromyces marxianus)产生的endo-PG的氨基酸序列与真菌的PGs有一定的相似性,N端25个残基为信号肽序列,218~230残基为PG的活性区域。
4.2 微生物果胶酶基因
近10年来,已从不同属的真菌、细菌和放线菌中克隆和测序的果胶酶基因至少有70个(表1),其中来自真菌的超过40个,且大多是多聚半乳糖醛酸酶基因。从中克隆到果胶酶基因的真菌主要有曲霉菌、炭疽菌、镰刀菌和灰霉菌等。例如目前已从黑曲霉(Aspergillus niger)中克隆到6个多聚半乳糖醛酸酶基因,6种endo-PGs之间的氨基酸序列同源性达58%~68%。草莓灰霉(Botrytis cinerea) 的6种endo-PGs的氨基酸序列同源性达34%~73%,聚类分析表明分属于3中不同的单系群体。在细菌中,对欧文氏杆菌的果胶酶基因研究较多,已经从菊欧文氏杆菌中克隆了8个果胶裂解酶基因和2个果胶酯酶基因,8个果胶裂解酶基因之间的氨基酸序列有很高的一致性,但Pell与其他7个不同,它自成一个转录单元。产生果胶酶的酵母菌株比较少,从酿酒酵母中克隆到的果胶酶基因是内切多聚半乳糖醛酸酶基因PGL1和PGU1,在基因组中均是单拷贝存在的。
真菌果胶酶基因的开放阅读框绝大多数被内含子分割。曲霉菌的果胶酶基因均含有内含子, 多数为3-4个,最多的达7个,如A.tubingensis的多聚半乳糖醛酸酶基因pgaX 。除Bcpgl不含内含子外,草莓灰霉的其他5个endo-PGs基因均含内含子。微生物果胶酶基因的表达与调控许多微生物果胶酶基因已在酵母菌中被正确表达。如茄镰孢豌豆专化型pelB、pelC和pelD的cDNA转入巴斯德毕氏酵母(Pichia pastoris)可以表达。果胶酶一般受果胶、植物维管组织、低浓度的(0.1%)D一半乳糖醛酸、半乳糖诱导,受葡萄糖、较高浓度(1%)的半乳糖醛酸、抗体、某些抗菌素(如阿莫西林)、植物的PG抑制蛋白(PGIP)抑制。有些果胶酶基因组成型表达。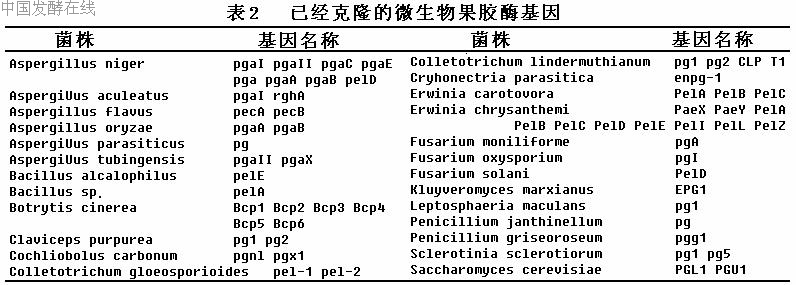
5、果胶酶的应用
5.1 利用果胶酶瓦解植物细胞的细胞壁
5.1.1 果蔬汁的生产,果酒的澄清
目前,在大部分的原果汁、浓缩果汁的生产过程中,都在使用果胶酶.由于各种水果中果胶的含量差别较大,而且果胶质的成分也略有差异,因此,要根据不同品种、不同加工目的来确定果胶酶的酶组成。由于PG 的专一性对果胶的酯化度要求不如PL高,在澄清果汁方面往往注重以PG为主的酶组成,而在提高浸出汁。特别是自流汁方面往往注重使用以PL为主的酶制剂。
5.1.2 天然产物的提取
果胶物质的存在不同程度的影响或阻碍着天然产物的释放。在适宜条件下,植物细胞会发生自溶也可产生包括果胶酶在内的分解酶类,但这会使待分离产物发生结构改变,甚至产生一些大多数情况下不利于分离的小分子副产物,因此,靠植物细胞的自身酶系并不利于天然产物的提取。一般应先热失活钝化胞内酶系,再有选择地进行酶处理。天然色素如葡萄紫、番茄红、紫苏紫、萝卜红等均可使用酶法提取,但所用果胶酶不得含有花青素酶等杂酶以免影响某些产品色泽。其次,天然生物活性物质提取物是目前中药进入国际市场的一种理想方式,出口比例已超过中药,并呈上升趋势。可利用果胶酶生产的提取物有:银杏叶提取物、大蒜油浓缩液、蘑菇浓缩液、人参浆、当归浸膏、甘草液等。另外,在金耳多糖、香菇多糖、金针菇多糖、山楂叶总黄酮。等的提取中也使用了果胶酶。利用酶类提取,不仅可提高萃取率,还可提高纯度。另外,在油料萃取方面,按照传统的生产工艺,菜籽油、棕榈油、葵花籽油、橄榄油等一般是由正己烷等脂溶性溶剂萃取制得,而正己烷是一种致癌物质。将果胶酶和纤维素酶、半纤维素酶结合使用,可破坏油料作物的细胞壁,便于油料的释放,从而提高萃取率。由于酶法提取条件温和,油料中多酚物质和VE都有所增加,从而提高油料的稳定性。
5.1.3 纺织品的生物脱胶
用碱性果胶酶处理,代替碱对棉、麻等织物进行煮练加工和整理工艺,以去除初生胞壁中的果胶物质,在比较缓和的pH值和温度条件下使处理后的织物手感柔软,强度高,取代了耗能大、污染严重的传统热碱脱胶工艺。另外,可避免因微生物处理造成的纤维素的降解。
5.1.4 造纸业的生物制浆
造纸工业中的生物制浆与纺织品的生物脱胶类似,都是通过果胶酶等酶处理降解植物纤维原料中的果胶、半纤维素及木质素,使其分散成满足造纸工业不同要求的束纤维或单纤维,以生产柔软、均一、有弹性的高品质材料。由于纸浆中高分子果胶带负电荷,经酶降解至六糖以下即可将其除去,避免了成品纸的静电现象。
5.2 部分分解细胞间质中的果胶物质
5.2.1 带果肉食品的生产
一般常规加工所得到的果肉在必要的高温处理或机械泵出后,成型颗粒量明显减少,硬度降低,直接影响了产品品质。果胶质在PE作用下脱去甲氧基,在钙离子存在下形成凝胶,从而保持了果肉原有的形状和硬度.以此为基料的产品有果汁、果冻、果肉酸奶、果肉冰淇淋等。
5.2.2 单细胞产品的生产
所谓单细胞产品是指将生物组织进行转化而形成的完整的单细胞悬液。这种单细胞内各种营养成分保存完好,表面及内部的张力较小,易稳定存在,而且易被酶类消化.它最初应用于细胞融合技术,随着制备技术的不断完善,这种单细胞产品可用于婴儿、老人及病人食品中,还可作为美容品中的活性成分,用于保湿、抗氧化、抑制黑色素生成等。酶法降解植物细胞闻质中的果胶物质产生完整的单细胞悬液的过程称为浸解作用(maceration).在浸解过程中,一方面设法使内源性果胶酯酶灭活,避免细胞软化;另一方面,用外源果胶酶适度降解胞外果胶及其它成分,避免胞内物质泄漏,降低品质。该工艺常用于生产带肉果蔬汁饮料、乳制品的配料、即食的干燥土豆泥、胡萝卜泥等食品,以及芦荟、人参、越橘叶、红花等美容保健品的配料。
5.3 利用果胶酶生产果胶低聚糖
5.3.1 以果胶为底物生产低聚果胶
PG可水解细胞壁中的果胶成分产生聚合度为10左右的寡聚半乳糖醛酸,后者是植物防御反应的诱导因子,防御作用包括产生有抗真菌活性的抗毒素,抑制蛋白合成的抑制剂等等,而且当endo-PG与其抑制蛋白结合以后可进一步激活此防御反应,所以PG在植物致病、抗病中具有双重作用.某些中草药中的药用成分也与果胶成分有关,如艾草叶中的果胶成分是一种生物活性成分,柴胡根中的抗溃疡糖类与果胶分子中的RG-II有关,而人参叶中的RG-Ⅱ也具有抗溃疡作用,柴胡根中的RG-I能够促进
鼠B细胞产生IL-6,增进机体免疫力,苍术根中的果胶片段具有肠道免疫活性。此外,果胶酶解产物还具有抑菌活性,可显著抑制乳酸菌的生长,还可作为功能性食品的配料。
5.3.2 以几丁质、几丁聚糖为底物生产低分子寡糖
PG可水解几丁质、几丁聚糖的β-(1,4)-糖苷键,得到水溶性寡糖。这类低分子寡糖具有多方面的生理功能,如抗肿瘤、抗菌、增强免疫机能,改善肠道微生物区系的分布,刺激有益菌的生长等.另外,几丁寡糖可作为保水剂、抗菌剂、植物生长调节剂等应用于农业、食品和化妆品业。
参考文献
[1] Pérez S, Rodriguez-Carvajal M A, Doco T.A complex plant cell wall polysaccharide:rhamnogalacturonan IL A structure in quest of a function[J].Biochimle,2003,85:109-121.
[2] Serge Pérez, Karim Mazeau, Catherine Herv du Penhoat. The three-dimensional structures of the pectic polysaccharides[J]. Plant Physiol.Biochem.2000, 38(1/2): 37-55.
[3] 张海燕,吴天祥。微生物果胶酶研究进展[J]。酿酒科技,2006, 9: 82-85
[4] Lang C, Domenburg H. Perspectives in the biological function and the technological application of polygalacturonases[J]. Appl Microbiol Biotechnol,2000, 53: 366-375.
[5] Kapoor M, Beg QK, Bhushan B, et a1.Production and partial puriflcation and characterization of a thermo-alkalistable polygalacturonasefrom Bacillus sp. MG-cp-2[J]. Process Biochem, 2000, 36: 467.
[6] Antier P, Minjares A, Roussos S, et a1.Pectinase hyperproducing mutants of Aspergillus niger C28B25 for solid state fermentation of cofee pulp[J].Enzyme Microbial Tehnol, 1993, 15: 254.
[7] Beg QK, Bhushan B, Kapoor M, et a1.Effect of amino acids on production of xylanase and pectinase from Streptomyces sp.QGl1-3[J]. World J Microbiol Biotechnol, 2000, 16:211.
[8] Lang C,Domenburg H.Perspectives in the biological functionand the technological application of poly- galacturonases[J]. Appl Microbiol Biotechnol, 2000, 53: 366-375.
[9] AlkortaI,Garbisu C,Llama MJ,Serra JL. Industrial applications of pectic enzymes-a review[J].Process Biochem,1998.
[10] Prade RA,Zohan D,Ayoubi P,Mort AJ.Pectins,pectinases and plant-microbe interactions[J].Biotechnol Genetic Eng Rev1999,l6:361-391.
[11] Hasunuma T,Fukusaki EI,Kobayashi A.Methanol production is enhanced by expression ofan Aspergillus niger pectin methylesterase in tobacco cells[J]. J Biotechnol 2003, 106: 45-52.
[12] Hadj-Taieb N,Ayadi M,Tfigui S,Bouabdollah F,Gargouri A.Hyper production ofpectinase activities by fully constitutivemutant(CT1)of PeniciUium occitanis[J]. Enzyme Microbial Technol, 2002, 30:662-666.
[13] Innocenzo MD, Lajalo FM.Effect of gammairradiationons oftening changes and enzyme activities during ripening ofpapaya fruit[J]. J Food Biochem. 2001,25:19-27.
[14] Assis SA, Ferreira BS, Fernandes P, et al. Gelatin immobilized pectinmethylesterase for production of low methoxyl pectin[J]. Food Chem. 2004, 86:333-337.
[15] Reid I, Richard M. Purified pectinase lowers cationic demand in peroxide-bleached mechanical pulp[J]. Enzyme Microbial Technol. 2004, 34: 499-504.
[16] Maldonaldo MS, Saad AMS. Production ofpectiIlesterase and polygalacturonase by Aspergillus n r in submerged and solid state systems[J]. J Ind Microbiol Biotechnol. 1998, 20:34-38.
[17]贾月, 弓爱君, 邱丽娜, 等.果胶酶分离纯化及分析方法的研究进展[J]. 工业微生物, 2005, 35(1): 55-58.
[18] A1ana A, Alkorta I, Dominguez J B, et al.Pectinlyase activityin a Penicillum italicum strain[J].Applied and Environmental Microbiology, 1990, 56: 375-3759.
[19] Bruhlmann F. Purification and characterization of an extracellular pectatelyase from an Amycolata sp.[J]. Applied and Environmental Microbiology, 1995, 61:3580-3585.
[20] Gainvors A, Nedjaoum N, Gognies,et a1. Purification and characterization of acidic endo-polygalacturonase encoded by the PGL1-1 gene from Saccharomyces cerevisiae[J].FEMS Microbiology Letters,2000, 183: 131-135.
[21]Schlemmer A F, Ware C F, Keen N T. Purification and characterization of a pectin lyase produced by Pseudomonas fluorescens W51[J]. Bacteriology, 1987.169: 4493-4498.
[22] 张红霞, 江晓路, 牟海津.微生物果胶酶的研究进展[J].生物技术, 2005, (15):92-95
[23] 高必达. 真菌果胶酶的分子生物学研究进展[J]. 生物工程进展, 2000, 20(6):14.
[24] Parenicova L, Benen J A, Kester H C, et a1. pgaA and pgaB encode two constitutively expressed endopolygalactumnases of Aspergillus niger[J]. Biochem J, 2000, 345: 637.
[25] Wubben J P, Mulder W, ten Have A, et al. Cloning and partial characterization of endopalygalactumnase genes from Botrytis cinerea[J]. Appl Envir Microbiol, 1999, 65:1596.
[26] Di Pietro A, Roncero M. Cloning, expression, and role in pathogenicity of pgl encoding the major extracellular endopolygalacturonase of the vascular wilt pathogen Fusarium oxysporum[J]. Mol Plant Microbe Interact, 1998.11(2): 91.
[27] Wei Y, shih J, Li J, et a1. Two pectin lyase genes, pnl-1 and pnl-2, from Colletotrichum gloeosporioides f. sp.malvae differ in a cellulose-binding domain and in their expression during infection of Malva pusilla[J]. Microbiology, 2002, 148(7):2149.