酶是细胞产生的以蛋白质为主要成分的生物催化剂,与化学催化剂相比较,具有作用条件温和、反应专一性强、反应副产物少等优点,因而广泛应用于医药、化工、食品、日化、农业、饲料、环保等领域,应用种类及用量均逐年递增。例如蛋白酶,应用于医药工业中,作为生化药物促进食物蛋白质消化;应用在食品工业中,水解蛋白质成肤,改善蛋白质溶解性及功能性质;应用在化学工业中,在有机介质中合成肤类物质等。
目前国内许多酶均为粗制品,杂质含量高,对产品影响较大,其销售和价格受到极大影响。因此,采用新技术、新工艺制备较高纯度的酶制品具有巨大的市场前景和经济效益,是值得开发的新领域。
酶是蛋白质,因此可用提取、分离蛋自质的方法进行纯化,获得相应产品。下面介绍几种酶的纯化新方法。
胰脏是动物的主要消化腺,含有多种酶及生物活性物质,例如核糖核酸酶A 、胰蛋白酶、胰凝乳蛋白酶和激肽释放酶等。核糖核酸酶A 分解RNA 的3 ' , 5’-磷酸二酯白酶(包括肪酶)分解蛋白质或肽的肽键。胰蛋白酶专一作用于由碱性氨基酸精氨酸及亮氨酸狡基所组成的肽键,是由胰蛋白酶原在肠激酶或自身催化下转化成的有活性的酶,该酶溶于水,不溶于氯仿、乙醇、乙醚和甘油;在pH < 3 时,钙离子对其有激活作用。糜蛋白酶(EC 3.4.4.5)又称胰凝乳蛋白酶,有多种类型,均由酶原激活产生。a -糜蛋白酶由3 条链组成,其活性中心氨基酸残基为His37 、Asp102 、Ser195 ,优先水解L-Tyr 和L - Phe 的梭基所形成的肽键;该酶PI8 . l- 8 . 6 ,分子量4200 0,最适pH8-9 。弹性蛋白酶( EC 3 . 4 . 4 . 7 )又称胰蛋白酶E ,其活性中心为His45 、Asp93 、Ser88 ; pI 为9 . 5 ,最适pH 7 . 4 - 10 . 3 。激肽释放酶(EC 3 . 4 . 4 . 21 )是内切水解酶,活性中心为丝氨酸和组氨酸,pI 为3 . 9 - 4 , 37 ,最适作用温度为37 ℃ ,pH 值为5 -7 . 8 。
蛋白质的分子量不同,其体积有明显差异,通过一定孔径的凝胶柱所需的时间不同,因此可用凝胶过滤进行分离;蛋白质表面主要为带电荷和极性不带电荷的氨基酸残基侧链基团组成的亲水区域所占据,这些基团分别与溶液中相反电荷的离子形成双电层或与水分子形成氢键。高浓度中性盐[例如〔 NH ;]。可破坏双电层并降低水分子活度,使蛋白质失去保护,相互聚集析出,因此用中性盐盐析可初步分离蛋白质。不同蛋白质的等电点有差异,其荷电性质及荷电量不同,可用带相反电荷的反胶束在常温下萃取,从而实现部分纯化;荷电的侧链基团可分别与带相反电荷的离子交换树脂形成离子键,因此用离子交换法也可以分离纯化蛋白质;此外,蛋白质表面的疏水区域(或非极性区域)可与疏水性(或非极性)吸附树脂形成吸附,极性区域则与极性吸附树脂形成吸附,因此,吸附法也可以部分纯化蛋白质。
实例233 反胶束萃取制备胰蛋白酶
胰蛋白酶(EC 3 . 4 . 4 . 4 )是从猪、牛等哺乳动物胰脏提取的一种以丝氨酸为活性中心的蛋白水解酶,可提高组织、血管的通透性、液化血块、血脓纤维及坏死组织等,用于治疗炎症、溃疡、创伤等引起的脓肿及支气管炎、肺气肿等。
( 1 )工艺流程
( 2 )主要步骤
① 制备粗酶液 称取定量粗胰酶,其胰蛋白酶活性为25 . 7U /mg,胰淀粉酶活性为18.4U/mg,胰脂肪酶活性为63.7U/mg。将其用pH 值为5 . 25 、浓度为0.2mol / L 的乙酸-乙酸钠缓冲液溶解,然后进行真空过滤,收集滤液并用磷酸缓冲液进行稀释,使胰蛋白酶活性为3-10U / mg ,备用。
② 制备反胶束 将AOT置于100 ℃ 烘箱中干燥至恒重,放入干燥器中冷却至室温。然后称取44.4369 置于配制罐中,加入10L异辛烷,在搅拌下使其形成均匀的分散液,再加入定量蒸馏水,在200r/min的转速下处理2h ,获得浓度为0 .lmol / L 的透明AOT-异辛烷反胶束溶液。使用时用异辛烷稀释10 倍。
③ 萃取 将稀释10 倍的AOT-异辛烷反胶束置于萃取器中,按照AOT 异辛烷反胶束:粗酶溶液体积比为(2 -3 ) : 1 的比例加入粗酶溶液萃取3 - 4 次,,在300 - 400r / min 的转速下萃取5 -10min 。如此每次萃取完成后,均进行离心分离,离心机转速为4000 - 6000r / min ,时间10 -15min 收集、合并离心上层清液,进行反萃取,下层萃余液用于制备胰脂肪酶。
④ 反萃取 将荷载胰蛋白酶的AOT -异辛烷反胶束置于萃取器中,在搅拌下加入等体积的反萃取液进行反萃取15 -20min 萃取液为0.02 -0.05mol / L 的NaCI 溶液。如此反萃取3 次,每次萃取完成后,均进行离心分离,离心机转速为4000 -6000r / min,时间为15 -20min 。分别收集、合并离心上层清液和下层反萃取液,前者再生后可再次萃取胰蛋白酶,后者进行超滤浓缩。
⑤ 脱盐、浓缩 将反萃取液置于截留分子量2 万的超滤膜中,在0 . 1 ~0.2MPa 的压力下进行脱盐及浓缩处理,直至处理液体积降低至原液体积的1 / 5 左右时停止,获得脱盐浓缩液。
⑥ 干燥 将浓缩液置于冻干瓶中,在-60~-50 ℃ 、真空度为25~5OMPa 的条件下干燥24h ,获得纯化胰蛋白酶冻干粉。
( 3 )主要指标
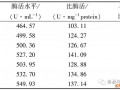
浅黄色粉末,胰蛋白酶的总萃取率为74 . 2 % ,胰蛋白酶活性为3145 . 3U/ mg ,纯化45 . 16 倍;胰淀粉酶活性为0 . 58U / mg ,降低4 . 66 倍;无脂肪酶活性。
实例234 猪胰中分离核糖核酸酶A、胰蛋白酶、凝乳蛋白酶和激肚释放酶
采用提取、盐析、反胶束、离子交换、凝胶分子筛层析等技术,可从猪胰脏中同时获得核糖核酸酶A 、胰蛋白酶、胰凝乳蛋白酶和激肤释放酶,有显著的经济效益。
( 1 )用该方法同时制备上述四种酶的工艺流程
( 2 )主要步骤
① 提取、盐析 取0.5kg 猪胰,除脂肪及结缔组织后绞碎,加入其3 倍质量的乙酸提取液搅拌提取24h 。提取液温度为4 ℃ ,pH 值为4 . 0 ,硫酸浓度为0.125mol / L 。提取完成后用4 层纱布过滤,收集滤过液约1250-1300mL ,在搅拌下加入约750g 固体硫酸钱溶解,使溶液达到75 %饱和度。4000r / min 转速离心15min , 分别收集上层清液(约1500mL )和盐析沉淀物(约40 -45g )。
② 制备核糖核酸酶A 取收集的上层清液,在搅拌下加入固体硫酸铵溶解,使溶液达到85 %饱和度。4 000r / min 转速离心15min ,弃清液。将沉淀溶于等体积蒸馏水,用10 %乙酸钠调节pH 值为6 . 0 ,上用浓度为0 .0lmol / L 、pH6 .0磷酸缓冲液(PBS ) 平衡过的CM - SepharoseFF 柱,CM - SepharoseFF 用量与上柱液体积之比为1 : 5 ( g / mL )。接着用2 倍树脂床体积的上述平衡缓冲液洗涤荷载核糖核酸酶A 的CM -SepharoseFF 色谱柱后,分别用0.01mol / L 、pH6 .0和0.lmol / L 、pH7 . 5 磷酸缓冲液进行梯度洗脱,收集活性峰液,调节其pH 值为8 . 0 ,上用0.05mol / L 、pH 8 . 0 磷酸缓冲液平衡的Sephacryls -200 柱,Sephacryls -200 用量与上柱液体积之比为1 : 5 (g/mL )。然后用同样的缓冲液梯度洗脱,收集活性峰液,进行透析、脱盐、冻干,获得核糖核酸酶A 冻干粉。
③ 制备胰蛋白酶取75 %饱和度的硫酸钱盐析沉淀,用10 倍蒸馏水溶解,加入盐析沉淀质量30 %的CaCI :粉末,调节pH 值为8 . 0 ,再加入5 ~ 10mg 粗胰蛋白酶,于4 ℃ 下激活24h 。过滤除去硫酸钙沉淀,调节滤液pH 值为7 . 8 ,加入定量对氨基苯甲脒-sepharose6B ,搅拌下吸附lh ,纱布过滤,收集滤液用于分离其他酶。将吸附胰蛋白酶的对氨基苯甲眯一S 叩harose6B 树脂用pH 值为7 . 8 、浓度为0 . lmol / L Tris 一0 .05mol / L HCI 的缓冲液(含0 . lmol / L CaC12 )抽滤洗涤,缓冲液用量为树脂体积的2 倍。洗涤完成后将树脂装柱,用其1 倍体积的相同缓冲液平衡。再用20 倍树脂体积的0 . lmol / L 甲酸-0 . 05mol / L KCI 缓冲液洗脱,洗脱液pH 值为2 . 2 ,洗脱流速为2 ~3 倍树脂体积/h 。收集洗脱活性峰进行透析,冻干,获得胰蛋白酶。
④ 弹性蛋白酶制备取未被对氨基苯甲脒-Sepharose6B 吸附的滤液,对水透析至透析管内产生沉淀时止。用400Or / min 的转速离心15min ,收集上层清液用于制备弹性蛋白酶。沉淀用5 ~ 6 倍体积的Tris-HCI 缓冲液溶解,该缓冲液浓度为0.02mol / L 、pH 值为8 . 8 。将溶解液用稀NaOH 调节pH 值为10 . 4 ,上用上述缓冲液平衡好的DEAE -纤维素柱,溶解液与DEAE -纤维素的比为(5 ~6 ) : 1 ( mL / g )。上柱完成后再用同样的缓冲液以2 ~3 倍树脂体积/h 的流速洗涤,缓冲液用量为1 倍树脂体积。弹性蛋白酶在此条件下不被交换,收集洗涤活性峰,对水透析,冻干,即得弹性蛋白酶。比活力2010U / mg ,活力回收10 %。
⑤ α-糜蛋白酶制备 将制备弹性蛋白酶时的离心清液用乙酸钠调节pH 值为5 .0,上用0 . lmol / L 、pH 5 . 0 柠檬酸缓冲液平衡的S- SepharoseFF 柱。用2 倍柱体积的、同样缓冲液以3mL / min 洗涤树脂,收集洗涤液待制备激肤释放酶。用300mL 0 . 01~0.05mol / L 、pH5.0柠檬酸缓冲液梯度洗脱,收集活性峰组分( 160 ~200mL ) ,透析,冻干,即得α-糜蛋白酶。
⑥ 胰糜蛋白酶制备 取制备弹性蛋白酶时的离心上层清液,用乙酸钠调节pH 值为3 . 5~ 4 . 0 ,加入等体积0.lmol / L AOT 反胶束,在200r /min 搅拌下萃取5min , 4000r / min 离心5min 。收集上层有机相,萃余液再用等体积0.lmol / L AOT 反胶束重复萃取2 次。合并有机相,加入等体积、含lmol / L KCI 、pH8.0的0.02mol / L 碳酸盐缓冲液,在200r /min 搅拌下反萃取5min , 60 00r/min 离心5min ,收集下层水相,萃余液同法反萃取2 次。合并反萃取液,对水透析脱盐,冻干,得胰糜蛋白酶。
⑦ 激肽释放酶制备 取用0.01mol/ L 、pH 5.0柠檬酸缓冲液洗涤S-SepharoseFF 柱的洗涤液,用柠檬酸调节pH 值为4 . 5 ,按洗涤液:丙酮=1:0.35 的比例加入丙酮,于-4 ℃ 冰箱中放置2h , 过滤。滤液中加入乙酸钠和NaCI ,使其浓度分别达到0.O65mol / L 和0.035mol / L 。继续加入丙酮,使体积比达到65 %。抽滤,滤饼用少量蒸馏水溶解,用稀乙酸调节pH 值为4 . 2 ,再次产生沉淀。抽滤,滤饼用少量蒸馏水溶解后用稀乙酸钠调节pH 值为6 . 8 ,对水透析脱盐后上用浓度为0.1mol / L 、pH6 . 8 磷酸缓冲液平衡的轻基磷灰石柱,上柱液与经基磷灰石的比为(5 ~ 6 ):l ( mL / g )。用0 . 01 ~0.2mol/L 、pH6 . 8 磷酸缓冲液以1~ 1 . 5 倍树脂柱体积/h 进行梯度洗脱,洗脱液用量约为上柱液体积的1~1 . 5 倍。收集活性峰组分,对水透析脱盐后加到经过重新平衡的另一羟基磷灰石柱上,改用0.05 ~0.2mol / L 、pH6 . 8 磷酸缓冲液进行梯度洗脱。收集活性峰组分,再次对水透析脱盐后,冻干,获得激肽释放酶。
( 3 )主要指标
核糖核酸酶A 的活力回收≥75 。%,比活力为71000U/mg;胰蛋白酶的活力回收≥60 % ,比活力为23750U / mg ;弹性蛋白酶的活力回收≥10 % ,比活力为2010 U / mg ;胰糜蛋白酶活力回收≥70 % ,比活力为150U / mg ;胰激肤释放酶活力回收≥6 % ,比活力为130U / mg 。