

同工酶技术自从20世纪60年代产生以来,在遗传学、发育生物学、疾病检测等方面得到了广泛的应用。在海洋生物中,主要应用于群体遗传分析[1-3],发育生物学[4],组织表达差异[5],细胞工程[6],遗传育种[7]和病害检测等方面。在海洋生物遗传分析中,经常检测的同工酶种类包括乳酸脱氢酶(LDH)、苹果酸脱氢酶(MDH)、苹果酸酶(ME)、异柠檬酸脱氢酶(IDH)、磷酸葡萄糖变位酶(PGM)和葡萄糖磷酸异构酶(GPI)。这些酶由于在能量代谢和营养物质的转换利用过程中起着非常关键的作用,酶活性表达比较强,因而也成为主要的分析酶类。其中PGM和GPI分析检测的频率在这些酶中更显突出。据统计,PGM和GPI在贝类的研究频率高达90%[8]。PGM在能量代谢过程中,催化机体的葡萄糖 1 磷酸生成葡萄糖 6 磷酸,这个反应是一个可逆的过程,生成的葡萄糖 1 磷酸和葡萄糖 6 磷酸分别是合成糖原和葡萄糖的前体。GPI在糖代谢的过程中催化6 磷酸葡萄糖转变为6 磷酸果糖。虾夷马粪海胆、刺参、半滑舌鳎、文蛤和虾夷扇贝是我国北方沿海几种重要的海水养殖物种。本文研究了PGM和GPI在上述5个物种部分组织的表达情况,并对其控制位点和群体遗传结构进行了分析。
1材料与方法
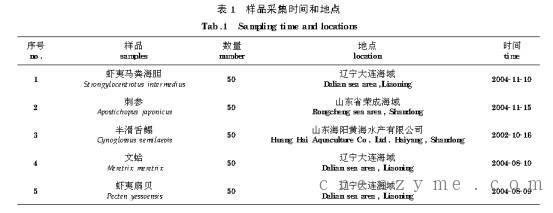
1.1 样品采集 虾夷马粪海胆、刺参、半滑舌鳎、文蛤和虾夷扇贝样品采集时间和地点如表1。
1.2实验方法 样品活体运回实验室解剖,取其各种器官组织,分装到1.5mL离心管中,-76℃保存。样品的制备、水平淀粉凝胶的制备、电泳、染色和位点的命名统计等参照文献[1,2]方法进行。
2 结果
2.1 虾夷马粪海胆 对虾夷马粪海胆雄性个体和雌性个体的成熟性腺组织和口器的肌肉组织分别取样分析。肌肉组织PGM只有Pgm 2一个位点表达,表现为单态。雄性性腺组织中PGM有Pgm 1,Pgm 2和Pgm 3三个位点表达,其中Pgm 1为多态位点(图版 1),在该位点检测到4种等位基因,位点杂合度观测值He(P0.99)为0.34,杂合子平衡偏离指数D为+0.0474。雌性性腺组织的PGM表达和雄性相同。GPI在海胆肌肉组织和性腺组织均表达为3个位点,其中Gpi 1和Gpi 2为单态位点, Gpi 3为多态位点。
2.2 刺参 分析了刺参体壁的肌肉组织和消化道组织的PGM和GPI。PGM在肌肉组织的活性稍高于在肠道中的活性,但是比肠道少Pgm 3位点。肠道Pgm 1为多态位点,该位点检测到四种等位基因,杂合子观测值He(P0.99)为0.38,杂合子平衡偏离指数D为-0.3045。Pgm 2和Pgm 3为单态位点(图版 2)。GPI在刺参肌肉组织和肠道组织中的表达一致,1个位点表达,多态(图版 3),检测到4种等位基因。杂合子观测值He(P0.99)为0.14,杂合子平衡偏离指数D值的为+0.057。
2.3 半滑舌鳎
半滑舌鳎肌肉组织中PGM检测到两个位点,其中迁移比较快的Pgm 1位点表达非常弱,可能是样品保存时间过长所致,迁移比较慢的Pgm 2位点活性表达很强(图版 4),均为单态位点。半滑舌鳎肌肉组织GPI检测到3个位点,酶活性比较高(图版 5),其中Gpi 1为多态位点,在该位点检测到至少3种等位基因,杂合子观测值He(P0.99)为0.20,杂合子平衡偏离指数D为+0.0146。Gpi 2和Gpi 3为单态位点。
2.4 文蛤
PGM和GPI在文蛤的闭壳肌中活性表达非常高。PGM闭壳肌中检测到1个位点,表现出非常高的多态性(图版 6),检测到5种等位基因,杂合子观测值He(P0.99)为0.72,杂合子平衡偏离指数D为0.0737。GPI分析为2个位点,均为为单态位点(图版 7)。2.5 虾夷扇贝 PGM和GPI在虾夷扇贝肌肉组织中的活性强于消化腺中的活性,无组织差异性。PGM在闭壳肌中表现为1个位点,多态(图版 8),4个等位基因,杂合子观测值He(P0.99)为0.28,杂合子平衡偏离指数D为-0.2670。GPI在闭壳肌中表达为1个位点,单态(图版 9)。
3 讨论
3.1 PGM和GPI位点在5种海洋生物中的遗传结构分析
虾夷马粪海胆的Pgm 1位点表现为杂合子过剩。这种杂合子过剩现象一方面表明所分析群体处于不稳定的遗传状态,从另一方面说明该位点为杂合子的个体在生存中相比纯合子的个体处于一定的优势。当然这种推断需要进行生长对比实验后才能证明。刘思阳等[9]在分析牙鲆Idh 1位点时,发现杂合子和牙鲆的存活率存在相关性。虾夷马粪海胆原产于日本北海道及以北沿海,上世纪90年代被引进到我国北方沿海进行大规模养殖,有关详细引进资料只有大连水产学院于1989年5月引进500个稚胆的报道,在此基础上,到1997年已经培养获得500万个稚胆和成胆[10]。通过对遗传变异比较活跃的位点进行分析,掌握该批引进虾夷马粪海胆群体经过近十年之后的的遗传结构变化是非常有价值的。
刺参的Pgm 1位点检测到4种等位基因,表现为杂合子缺失现象。刺参为活动能力比较弱的底栖海洋生物,主要生活在底栖藻类比较繁盛的海域,以藻类和植物碎屑为食。其能量的代谢应该以多糖类的物质为主,而PGM是催化糖代谢过程中的一个非常重要变位酶,Pgm 1位点等位基因的丰富性使海参对于营养物质的吸收有更多选择的余地。海参有夏眠的习性,11月份应该是海参结束夏眠,摄食比较活跃的季节,这也是海参PGM活性比较高的原因。刺参肠道组织的GPI检测到4种等位基因,其预期基因型应该为10种,但是实际只检测到4种基因型个体,表现为杂合子过剩状态(D=+0.057)。作者分析应该是某些基因型,特别是某些纯合型的个体在竞争中处于不利地位导致个体消亡,从而出现杂合子相对过剩的现象。
由于样品保存时间过长(2002年10月采集的样品),半滑舌鳎Pgm 1位点只有很弱的酶带被检测到(作者在2002年以新鲜样品进行实验时,能够检测到酶活比较强的Pgm 1位点),可能是Pgm 1位点的稳定性不如Pgm 2位点所致,这种现象在扇贝的异柠檬酸脱氢酶中也有发现[11]。半滑舌鳎肌肉组织GPI检测到3个位点,Gpi 1为多态位点,表现为轻微的杂合子过剩状态。对于某些基因位点,一旦以稀有等位基因的形式出现,往往在群体中无法检测到纯合型个体的存在,而是以杂合子的形式存在,这种情况经常造成了杂合子过剩的现象。Gpi 2和Gpi 3为单态位点。
文蛤PGM位点表现出非常丰富的等位基因,本实验中检测到5种等位基因,7种以上的基因型个体。在该位点表现为轻微的杂合子过剩现象。文蛤成体营底栖半固着生活,但是在其十多天的浮游生活阶段,海水洋流使不同遗传背景的文蛤得到了充分的交流,因而也创造出基因型丰富的群体。贝类的PGM具有丰富的遗传多样性是很普遍的现象,薛钦昭等[12]利用PGM对海湾扇贝6个不同的地理群体进行了遗传分析,检测到6种等位基因,观测到多达12种基因型,发现不同地理群体的杂合子和纯合子的存活率是有差异的,不同基因型个体在体高、体长和体宽的生物学指标方面是有差异的,而这种差异和Pgm位点等位基因的变化存在一定的相关性。文蛤GPI检测到两个位点,都是单态位点,表达比较单一。
虾夷扇贝肌肉组织的PGM检测到4种等位基因,5种基因型。虾夷扇贝是20世纪80年代我国从日本引进的1种经济型贝类,主要在我国北方沿海进行养殖。本文PGM位点表现为杂合子缺失状态,和高悦勉[13]对大连沿海4个海区的虾夷扇贝5种同工酶(CAT,SOD,MDH,ME,EST)的分析结果相一致,在人工养殖生产中存在由于亲本个体少导致的近交和遗传漂变现象的发生。虾夷扇贝肌肉组织的GPI检测到一个位点,单态。表明GPI在扇贝肌肉组织中是一种非常保守的酶类,这对于维持机体糖类的代谢稳定非常重要。
3.2 PGM和GPI在遗传分析中的应用
PGM和GPI是海洋生物表达非常活跃的两种酶类,往往在染色开始的几分钟之内就可以观察到酶带的出现,其活性在合适的条件下往往可以保持很长时间。由于具有非常高的遗传变异水平,PGM和GPI是衡量物种遗传变异水平很重要的两种酶类。对于某些遗传变异水平比较低的物种,比如中国明对虾(Fenneropenaeuschinensis),往往一个群体的Hardy Weinberg平衡指数会因为PGM或者GPI位点杂合子平衡偏离指数的变化而变动[1]。利用某些同工酶位点和等位基因的丰富性,用一种酶来衡量种群的遗传变异规律,并且利用其作为生物体某些性状的生化指标[9,12],这在选种育种中是非常有意义的。同样,利用基因某些位点等位基因的多态性,比如文蛤PGM位点,实验中检测到五种等位基因,理论上可以有15种基因型组合,在家系选育过程中,可以将来自不同基因型亲本产生的不同家系混养在一起,利用个体的基因型将不同家系区分开来,从而可以使所有家系的环境因子相同,排除分开养殖而形成的环境差异,同时可以节约大量的养殖设施。这与利用微卫星技术对亲本和子代进行分子标识的原理一样。
参考文献:
[1] WangWJ,KongJ,BaoZM,etal.Iszoymevariationinfourpopulationsof
Penaeuschinensisshrimp[J].BiodiversityScience,2001,9(3):241-246.
[2] 王伟继,孔 杰,庄志猛,等.真鲷野生群体和人工繁殖群体的同工酶遗传差异[J].生物多样性,2000,8(4):391-396.
[3] 杨 锐,喻子牛,陈再忠,等.山东沿海褶牡蛎与太平洋牡蛎等位基因的遗传变异[J].水产学报,2000,24(2):130-133.
[4] 张志峰,马英杰,廖承义,等.中国对虾幼体发育阶段的同工酶研究[J].海洋学报,1997,19(4):63-71.
[5] 李太武,吕振明,林志华,等.泥蚶同工酶谱在不同组织的差异研究[J].海洋学报,2004,26(4):125-132.
[6] 赵 俊,崔 淼,庆 宁,等.雌核发育彭泽鲫子代及双亲组织同工酶的比较研究[J].华南师范大学学报(自然科学版),2004,1:96-101.
[7] SbordoniV,MatthaeisED,Cobdli.Bottleneckeffectsandthedepressiono
fgeneticvariabilityinhatcherystocksofPenaeusjaponicus(Crustacea:Decapoda)[J].Aquaculture,1986,57:239-251.
[8] 吕振明.泥蚶同工酶的时空表达与遗传变异研究[D].宁波大学硕士论文,2003.
[9] 刘思阳,池田实,藤尾芳久.牙鲆群体Idh 1基因座位杂合型个体选择性优势[J].武汉大学学报(自然科学版),2000, 46(4):495-499.
[10]常亚青,王子臣.虾夷马粪海胆筏式人工养殖研究[J].大连水产学院学报,1997,12(2):7-14.
[11]陈再忠.中国北方沿海栉孔扇贝[(Chlamysfarreri(Jones&Preston]三个自然群体遗传变异的初步研究[D].中国海洋大学硕士论文,1999.
[12]薛钦昭,SheilaStiles,张福绥,等.海湾扇贝不同种群在磷酸葡萄糖变位酶基因位点的遗传结构与性状[J].海洋与湖沼,1999,30(4):381-390.
[13]高悦勉,李国喜,张银丽.大连沿海虾夷扇贝养殖群体遗传结构的研究[J].大连水产学院学报,2004,19(2):142-145.


