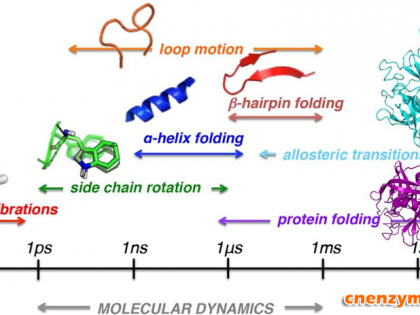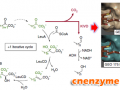
图1. 蛋白不同类型运动的时间尺度示意图
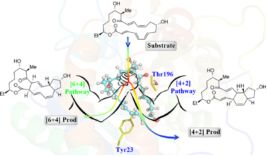
图2. SpnF酶中可能的[4+2]与[6+4]环合反应机制
周环反应在有机合成中有广泛应用,许多有机人名反应在自然界中都能找到相关功能的酶[2],例如,催化[4+2]类型Diels–Alder周环反应的酶相继得到实验报道[3, 4],理论模拟方面,以SpnF酶为例,Houk团队在早期的气相模拟中揭示了SpnF酶潜在的[6+4]环合分支反应可能性[5],因而对这类酶是否是单功能的Diels–Alderases,又或者可能存在[4+2]和[6+4]两种环合反应杂泛性的可能,仍然存在争议。近期,Houk团队[6]基于微扰理论的过渡态采样,以及Hess等人[7]基于全酶体系的QM/MM MD计算都阐明了催化[4+2]反应才是SpnF酶的主要活性,尽管的确存在一个[4+2]与[6+4]分支反应共享的过渡态区域,如图2所示。
Hess等人选取了二维反应坐标来开展其QM/MM MD 模拟,QM部分选择的是M06-2X方法,该方法在研究环合反应中广泛使用。他们通过考虑不同大小的QM区域来获得关键氨基酸残基对酶反应的调控作用。如图3所示,随着关键氨基酸残基,如Tyr23, Thr196和Trp256考虑到QM区域,发生[6+4]分支反应的概率逐步下降,这是因为它们与配体的相互作用(氢键和p-堆积),有利于底物处于[4+2]反应活性构象。特别是Thr196效果最为显著,它与底物的作用削弱了C13−C14双键特性从而抑制[6 + 4]反应性,在Thr196Ala突变模拟中,[6 + 4]反应概率提升到90%而在wild type中[6 + 4]环合反应比重仅占到5.6%。计算还发现,即便反应能形成[6 + 4]副产物, Thr196这一关键氨基酸残基也会促进其进一步重排得到最终的 [4 + 2] 产物。而Tyr23/Trp256与底物的p-堆积作用使得C2=C3双键周围电子更加离域。SpnF之所以存在一定概率的[6 + 4] 环合反应,主要是Asn148和Leu198残基对配体的影响,更利于[6 + 4]反应活性。但针对过渡态分支区域开展的详尽的QM/MM MD采样结果表明[4+2]环合才是SpnF催化的主反应(图4)。该论文作者进一步分析提出,与其它已知的Diels−Alderases酶不同之处是, SpnF 酶不仅利用氢键作用,还利用了芳香堆积效应来提高酶反应在[4+2]与[6+4]之间的选择性。这些发现为未来Diels−Alderases蛋白设计提供了重要的理论指导。
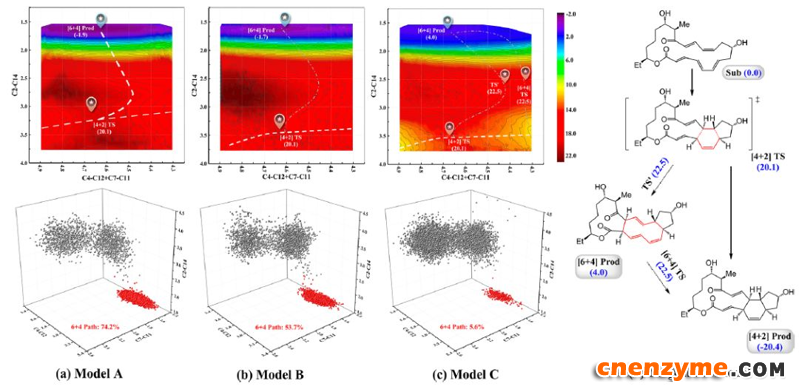
图3. 不同QM区域下获得的反应自由能图及其[6+4]产物比重。AàC三个model中关键氨基酸数目逐渐增加
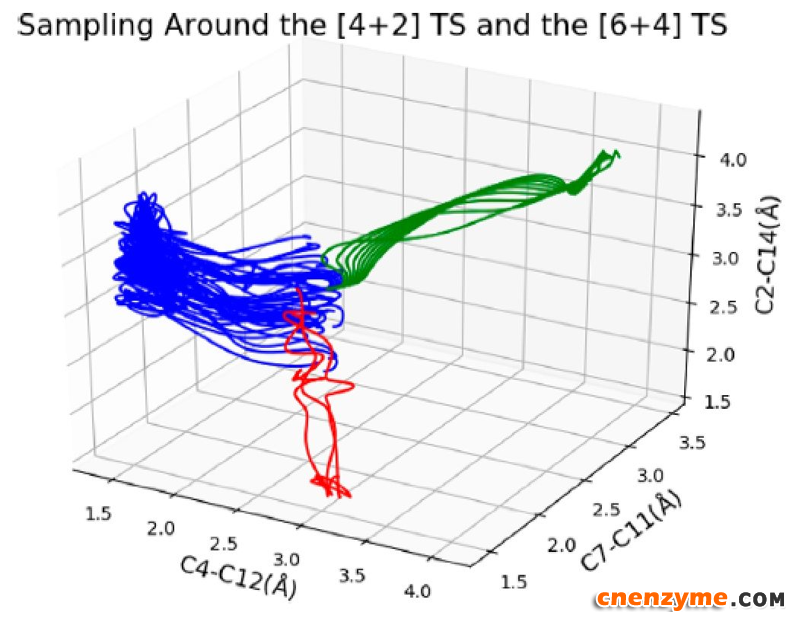
图4. 从过渡态区域出发的QM/MM 非限制性MD 采样结果统计分析。蓝色线代表通往[4+2]产物的反应轨迹,绿色线代表返回反应底物态的轨迹数,红色线代表了[6+4]分支反应的数目
为了研究SpnF酶和水溶液对分叉反应的影响,Houk团队[6]则利用其课题组发展的基于环境微扰的过渡态采样方法(EPTSS),比较研究了在SpnF酶和水溶液中DA反应机理。他们的计算模拟发现,底物分子的过渡态在水和酶不同载体中采取的优势构象有较大差异,研究结果表明在酶SpnF中存在[4+2]与[6+4]的分叉过渡态,并且针对分叉过渡态对比了水与酶环境下[4+2]/[6+4]产物比率,水中为1.6:1.0酶中为11:1,随后他们还详细揭示了酶中关键氨基酸的催化调控作用。最终,他们提出了在SpnF酶反应中,与传统的化学理论中的热力学(thermodynamics)控制与动力学(kinetics)控制不同的观点,认为这是一种全新的蛋白氨基酸“动态学效应”(dynamical effects)所控制的酶催化调控作用。
参考文献
1. Osuna, S., et al., Molecular Dynamics Explorations of Active Site Structure in Designed and Evolved Enzymes. Accounts of Chemical Research, 2015. 48(4): p. 1080-1089.
2. Lin, C.I., R.M. McCarty, and H.W. Liu, The Enzymology of Organic Transformations: A Survey of Name Reactions in Biological Systems. Angewandte Chemie-International Edition, 2017. 56(13): p. 3446-3489.
3. Fage, C.D., et al., The structure of SpnF, a standalone enzyme that catalyzes 4+2 cycloaddition. Nature Chemical Biology, 2015. 11(4): p. 256-+.
4. Ohashi, M., et al., SAM-dependent enzyme-catalysed pericyclic reactions in natural product biosynthesis. Nature, 2017. 549(7673): p. 502-+.
5. Patel, A., et al., Dynamically Complex 6+4 and 4+2 Cycloadditions in the Biosynthesis of Spinosyn A. Journal of the American Chemical Society, 2016. 138(11): p. 3631-3634.
6. Yang, Z.Y., et al., Influence of water and enzyme SpnF on the dynamics and energetics of the ambimodal 6+4 / 4+2 cycloaddition. Proceedings of the National Academy of Sciences of the United States of America, 2018. 115(5): p. E848-E855.
7. Chen, N.H., et al., Biosynthesis of Spinosyn A: A 4+2 or 6+4 Cycloaddition? Acs Catalysis, 2018. 8(3): p. 2353-2358.