, Xinglong Yang, Shaobin Zhan, Rongzhen Tian, Yao Nie, Yan Xu
, Xinglong Yang, Shaobin Zhan, Rongzhen Tian, Yao Nie, Yan Xu 烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide),是一种传递电子(氢离子)的辅酶,KEGG数据库显示NADH/NAD+作为重要的辅因子全程参与微生物细胞内的740多个代谢反应[1-4],在糖酵解、糖异生、三羧酸循环和呼吸链中发挥着不可替代的作用。NAD (H)能为代谢网络中各种反应提供能量和氧化还原力,其浓度可以调控代谢网络途径,增大代谢流通量,提高氧化还原反应中生物催化效率和目标产物的产率;两者的比例对胞内的氧化还原力水平有一定的调节作用,同时影响代谢产物的分布。
调控NAD (H)的浓度可以改变细胞代谢功能,大量增加NAD+的供给能扩大代谢网络通量,氧化型产物会相对增加[5];在大肠杆菌中,当NADH/NAD+比例超过0.6时,细胞中NADH的生成速率超过电子传递链氧化磷酸化容量,代谢产物为乙酸积累[6];降低NAD (H)浓度,会制约质子梯度的形成,ATP生成量减少,糖酵解和三羧酸循环代谢流的效率随之降低[6-7]。例如在利用光滑拟球酵母生产丙酮酸过程中,增加NAD+的含量,增强了3-磷酸甘油醛酶的活力,从而加快糖酵解的速率,提供其氧化推动力,使丙酮酸产量提高了44%[8]。当提高胞内NAD+含量时,NAD+依赖型氧化还原反应速率也随之提高。研究表明在酶促催化生成L-叔亮氨酸氧化还原反应中,外加0.1 mmol/L NAD+能在5 h内实现100%转化,不添加或者少添加辅酶,则不能实现完全转化[9]。Wu等在利用胞内NAD+含量达1.45 μmol/g的活细胞作为生物催化剂时,生物催化效率提高15倍[10]。外加辅酶虽然能提高反应速率,但是价格比较昂贵增加了生产成本,于是很多人开始研究提高细胞自身的辅酶浓度来增强相关代谢反应的效率。
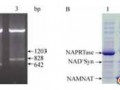
然而,胞内NAD+合成途径复杂、前体物及NAD+降解支路多、积累量少以及合成效率低等都是细胞利用自身NAD+的瓶颈问题,因此,如何增加胞内NAD+含量提高其利用率成为国内外研究热点。强化辅酶合成主要从增加途径中的关键酶和增加前体物两方面考虑。Berríos-Rivera等[11]通过过量表达基因pncB编码的烟酸磷酸核糖转移酶(NAPRTase),促使E. coli胞内NAD+、NADH和总NAD (H)分别提高了81.8%、29.8%和41.7%;Gou等[12]通过在E. coliNZN111中过量表达基因nadD 编码的烟酸单核苷酸腺苷酰转移酶(NAMNAT),NAD+浓度提高3.3倍可达到12.64 μmol/g DCW,从而减少了副产物丙酮酸的积累促进丁二酸的合成。Liu等[8]在发酵培养基中加入NAD+的生物合成前体烟酸(NA),发现8 mg/L前体物NA能够有效促进细胞内NAD+的合成,使光滑球拟酵母Torulopsis glabrata葡萄糖消耗速度和丙酮酸产量分别提高了48.4%和29%。
目前的报道,大多数是针对某一发酵产物改变辅酶的浓度,并没有以辅酶为主要研究对象,对不同代谢调控策略进行比较。缺少对合成NAD+的系统研究,如:比较NAD+补救途径中3个关键酶作用大小,考察不同前体色氨酸、天冬氨酸、喹啉酸、烟酸和烟酰胺等对NAD+含量的影响。
本研究主要从代谢途径、前体物质添加和发酵条件优化这三方面对提高胞内NAD+含量进行系统研究。首先研究NAD+的生物合成路径见图 1[13-14],改造补救途径,强化关键酶基因pncB、nadD和nadE,比较单独过量表达和组合共表达对胞内NAD+含量的影响,研究这3个关键基因之间的关系;其次,筛选出最优菌株对其进行外源调节,包括不同前体物质的添加、外部环境的调控,进一步提高NAD+积累量;最后,考察3个影响NAD+含量的显著性因素,通过最陡爬坡试验逼近最大响应区域,得到最佳的发酵条件使胞内NAD+含量能够达到最大化,为解决高效利用底物、增加目标产物和提高NAD (H)依赖型生物催化反应效率等问题提供思路和方案。
 |
| 图 1 辅酶NAD+合成图Figure 1 Illustration of NAD+ synthetic pathways. Chemical structures of NAD+ and relevant intermediates (R: ribose sugar, P: phosphoric acid, Ad: adenine). Abbreviations of compounds: L-Trp: L-tryptophane; Asp: asparticacid; QA: quinolinic acid; NA: nicotinic acid; NaMN: nicotinic acid mononucleotide; NaAD: nicotinic acid adenine dinucleotide (Deamino-NAD); NAD+: nicotinamide adenine dinucleotide; NAM: nicotinamide; NR: nicotinamide riboside; NMN: nicotinamide mononucleotide. |
1.1.1 菌株质粒与引物: 菌株Escherichia coli BL21(DE3) 由本实验室保存,表达质粒pET-21a (+)由本实验室前期构建与保存,本文所使用的引物序列见表 1。
| Primers | names Primer sequences (5′→3′) |
| pncB-F | CGCGGATCCATGACACAATTCGCTTCT |
| pncB-R | CCGCTCGAGTTAACTGGCTTTTTTAATATGCGG |
| nadD-F | CGCGGATCCATGAAATCTTTACAGGCTC |
| nadD-R | CCGCTCGAGTCAGCGATACAAGCCTTGTT |
| nadE-F | CGCGGATCCATGACATTGCAACAACAAAT |
| nadE-R | CCGCTCGAGTTACTTTTTCCAGAAATCATCG |
| B-SD-AS-D-F1 | CGCGGATCCATGACACAATTCGCTTCT |
| B-SD-AS-D-R1 | TGTATATCTCCTTCTTTAACTGGCTTTTTTAATATGCGGAAG |
| B-SD-AS-D-F2 | AGAAGGAGATATACAATGAAATCTTTACAGGCTCTGTTTGG |
| B-SD-AS-D-R2 | CCGCTCGAGTCAGCGATACAAGCCTT |
| B-SD-AS-E-F1 | CGCGGATCCATGACACAATTCGCTTCT |
| B-SD-AS-E-R1 | TGTATATCTCCTTCTTTAACTGGCTTTTTTAATATGCGG |
| B-SD-AS-E-F2 | AGAAGGAGATATACAATGACATTGCAACAACAAATAATAAAGGC |
| B-SD-AS-E-R2 | CCGCTCGAGTTACTTTTTCCAGAAATCATCG |
| D-SD-AS-E-F1 | CGCGGATCCATGAAATCTTTACAGGCTC |
| D-SD-AS-E-R1 | TGTATATCTCCTTCTTCAGCGATACAAGCCTTGTTGGT |
| D-SD-AS-E-F2 | AGAAGGAGATATACAATGACATTGCAACAACAAATAATAAAGGC |
| D-SD-AS-E-R2 | CCGCTCGAGTTACTTTTTCCAGAAATCATCG |
| E-SD-AS-B-F1 | CGCGGATCCATGACATTGCAACAACAAATAATAAAGGC |
| E-SD-AS-B-R1 | TGTATATCTCCTTCTTTACTTTTTCCAGAAATCATCG |
| E-SD-AS-B-F2 | AGAAGGAGATATACAATGACACAATTCGCTTCT |
| E-SD-AS-B-R2 | CCGCTCGAGTTAACTGGCTTTTTTAATATGCGG |
| The restriction endonuclease sites are underlined; the sequences of SD-AS linker are bold. | |
1.1.2 主要试剂: PCR试剂、限制性内切酶、pMD™19-T Vector Cloning Kit、T4 DNA连接酶、DNA marker购自大连宝生物工程有限公司;protein marker (low)购于碧云天;质粒小量抽提试剂盒、PCR产物纯化试剂盒、胶回收试剂盒、PCR引物、氨苄青霉素、卡那霉素、IPTG购自上海生工生物工程有限公司;NAD+、NADH购自Sigma Aldrich公司;酵母膏提取物、胰蛋白胨Oxoid原装进口;其余分析级生化试剂均购自国药集团。
1.1.3 培养基及培养条件:摇瓶种子培养基及发: 酵培养基均采用LB培养基(NaCl 10 g/L、胰蛋白胨10 g/L、酵母膏提取物5 g/L,pH 7.2),并添加终浓度为100 μg/mL的氨苄青霉素;培养条件为37 ℃、200 r/min。除摇瓶发酵培养时间为18 h外,其余情况均培养12 h。1.2 基因pncB、nadD和nadE的克隆
根据NCBI上报道的大肠杆菌中基因pncB的序列(Gene ID: 8182321)、基因nadD的序列(Gene ID: 8180157) 和基因nadE的序列(Gene ID: 8179982) 设计上下游引物,提取E. coli BL21(DE3) 的基因组,PCR克隆扩增得到基因pncB、nadD和nadE,引入酶切位点Bam H I和Xho I。PCR反应体系(50 μL):上下游引物各1 μL,模板DNA1 μL,PrimeSTAR HS (Premix) 25 μL,dd H2O 22 μL。PCR反应条件:98 ℃ 30 s;98 ℃ 10 s,55 ℃ 30 s,72 ℃分别延伸80 s、42 s、55 s,30个循环;72 ℃ 10 min。采用琼脂糖凝胶电泳法验证PCR扩增结果。
1.3 单基因重组质粒的构建先将目的基因产物纯化后,连接到pMD-19T载体,转化筛选阳性克隆并测序。再将载体pET-21a和T载上的目的基因用限制性核酸内切酶Bam H I和Xho I酶切90 min,经琼脂糖凝胶电泳回收纯化目的基因片段和质粒骨架,在T4连接酶作用下16 ℃连接过夜。然后将连接产物转化JM109克隆宿主感受态细胞,在氨苄青霉素抗性平板上筛选阳性克隆转化子。最后挑取转化子,并提取质粒双酶切验证,转化大肠杆菌表达宿主BL21(DE3),对重组质粒进行平板筛选和测序。
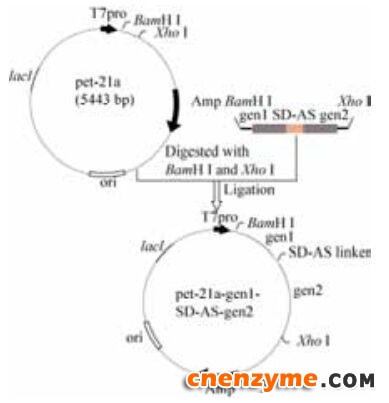
1.4 双基因共表达重组质粒的构建关键基因两两组合共表达的构建流程如图 2所示,其中以Bam H I和Xho I为酶切位点,SD-AS序列为共表达体系中的连接肽,将2个基因扩增并连接在载体上。
 |
| 图 2 双基因组合共表达载体的构建图谱Figure 2 Map of construction of double gene combined co-expression vector. |
|
图选项
|
1.5 NAD (H)合成相关酶的诱导表达
用LB氨苄青霉素平板活化重组菌株,挑取单菌落接入5 mL含有终浓度100 μg/mL氨苄青霉素的LB试管中,培养12 h后再按1%的接种量转接于50 mL的LB发酵培养基中,37 ℃、200 r/min培养3 h后添加终浓度为0.1 mmol/L的IPTG,17 ℃、200 r/min诱导15 h后进行SDS-PAGE分析和NAD+含量的测定。
1.6 NAD (H)含量的测定样品中NAD+的提取:收集细胞到离心管内并用超纯水重悬,弃上清,称取0.1 g湿菌体,加入1 mL酸性提取液,超声波破碎(冰浴,功率20%或200 W,超声3 s,间隔10 s,重复30次),95 ℃水浴5 min (盖紧,以防止水分散失);冰浴中冷却后,10000× g、4 ℃离心10 min;取500 μL上清液,加500 μL碱性提取液使之中和,混匀。10000× g、4 ℃离心10 min,取上清,置冰上待测[15-16]。
测定原理:采用酶循环法,由于NAD+可被乙醇脱氢酶还原为NADH,NADH通过递氢作用,还原氧化型噻唑蓝(MTT)为甲瓒,在570 nm下检测吸光值的变化。辅酶NAD (H)浓度测定的具体操作步骤参照文献[17-20]。
1.7 重组菌株生物量的测定细胞培养结束后,12000 r/min离心10 min收集菌体,用超纯水洗涤、离心,去除菌体表面粘附的杂质成分,再将离心好的菌体在抽真空的条件下冷冻干燥至恒重,测定细胞干重(Dry cell weight,DCW)。
1.8 NAD (H)合成前体物质的添加在发酵培养基中添加NAD (H)合成路径中的前体物质,即色氨酸、天冬氨酸、喹啉酸、烟酸和烟酰胺。前体物质用超纯水配制成5 g/L的母液,过滤除菌、分装并低温保存,在转接于摇瓶发酵培养基时加入。