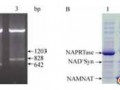
选取NAD+补救途径中烟酸磷酸核糖转移酶(NAPRTase)、烟酸单核苷酸腺苷酰转移酶(NAMNAT)和NAD+合成酶(NAD+ synthetase)的编码基因,克隆构建获得重组质粒pET-21a-pncB、pET-21a-nadD和pET-21a-nadE,经限制性内切酶Bam H I和Xho I酶切鉴定,其条带大小分别为1203、642和828 bp (图 3-A),经测序后比对匹配一致,pET-21a-pncB、pET-21a-nadD和pET-21a-nadE构建成功。
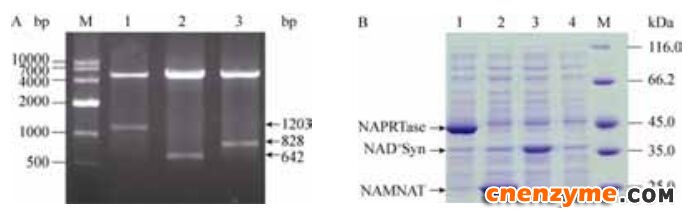 |
| 图 3 重组质粒双酶切鉴定及SDS-PAGE分析图Figure 3 SDS-PAGE analysis and identification of the recombinant plasmid by enzyme digestion. A: identification of the recombinant plasmid by enzyme digestion. Lane 1: pET-21a-pncB; lane 2: pET-21a-nadD; lane 3: pET-21a-nadE; M: DL10000 DNA marker. B: SDS-PAGE analysis of recombinant strains for over-expressed enzyme. Lane 1: pET-21a-pncB; lane 2: pET-21a-nadD; lane 3: pET-21a-nadE; lane 4: pET-21a; M: protein molecular marker. |
|
图选项
|
对E. coli BL21/pET-21a和构建的重组菌株进行粗酶液的SDS-PAGE分析验证(图 3-B)。与空白组4号泳道对比,重组菌E. coli BL21/pET-21a-pncB、BL21/pET-21a -nadD和BL21/pET-21a-nadE分别在约45、25和35 kDa处有一条明显特征条带,表明基因pncB、nadD和nadE编码的NAPRTase、NAMNAT和NAD+ synthetase在大肠杆菌中成功表达。
分别测定重组菌株的生长情况和胞内辅酶NAD+含量(表 2),在细胞量上,重组菌株的生物量较原始菌株提高20%;在NAD+含量上,重组菌株中合成NAD+关键酶基因pncB、nadD和nadE得到了过量表达,胞内NAD+的浓度分别提高了252.4%、101.7%和275.4%。可见,过量表达关键酶基因可以使细胞生物量和NAD+总量得到一定的提高。3株重组菌之间也有一定的差异,其中基因pncB和nadE的过量表达对提高辅酶含量的比例较大,而基因nadD提高辅酶的幅度稍小。
| Recombinant strains | OD 600 | Biomass/(g DCW/L) | NAD+ content/(μmol/g DCW) | Relative ratio/% |
| E. coli BL21/pET-21a E. coli BL21/pET-21a-pncB E. coli BL21/pET-21a-nadD E. coli BL21/pET-21a-nadE |
1.29±0.07 1.75±0.08 1.85±0.07 1.82±0.17 |
1.40±0.03 1.69±0.04 1.72±0.07 1.71±0.13 |
3.78±0.37 13.31±1.20 7.63±0.08 14.19±0.69 |
100.00 352.35±31.73 201.67±16.92 375.40±18.11 |
2.2 NAD+合成途径中2个关键基因共表达的克隆及表达
为进一步提高胞内NAD+的含量,采用共表达策略,利用重叠延伸PCR技术构建重组质粒pET-21a-pncB -nadD、pET-21a-nadD -nadE、pET-21a-pncB -nadE和pET-21a-nadE -pncB。
经限制性内切酶Bam H I和Xho I双酶切鉴定(图 4),5000 bp左右的条带为质粒骨架pET-21a而稍小的条带为目的基因。经过测序比对,目的条带序列与已公布的匹配一致,共表达重组质粒构建成功。
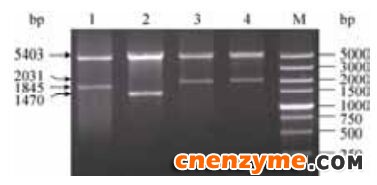 |
| 图 4 双酶共表达重组质粒的酶切验证Figure 4 Identification of the co-expression recombinant plasmid by enzyme digestion. Lane 1: pET-21a-pncB -nadD; lane 2: pET-21a-nadD -nadE; lane 3:pET-21a-pncB -nadE; lane 4:pET-21a-nadE -pncB; M: DL5000 DNA marker. |
|
图选项
|
离心收集共表达重组菌株细胞,测定其胞内辅酶NAD+的含量和细胞干重(表 3),重组菌E. coli BL21/pET-21a-nadE-pncB胞内NAD+含量进一步提高,而E. coli BL21/pET21a-pncB -nadD胞内的辅酶含量比较低,结合SDS-PAGE图(图 5)发现基因pncB编码的NAPRTase和nadD编码的NAMNAT表达量较低。
| Recombinant strains | OD 600 | Biomass/(g DCW/L) | NAD+content/(μmol/g DCW) | Relative ratio/% |
| E. coli BL21/pET-21a | 1.29±0.07 | 1.40±0.04 | 3.82±0.27 | 100 |
| E. coli BL21/pET-21a-pncB -nadD | 2.02±0.12 | 1.75±0.14 | 5.67±0.21 | 148.43±5.50 |
| E. coli BL21/pET-21a-nadD -nadE | 1.81±0.07 | 1.68±0.16 | 14.21±0.58 | 371.99±15.18 |
| E. coli BL21/pET-21a-pncB -nadE | 1.82±0.06 | 1.60±0.10 | 16.33±0.93 | 427.49±24.34 |
| E. coli BL21/pET-21a-nadE -pncB | 1.65±0.09 | 1.57±0.15 | 19.30±0.65 | 505.23±17.02 |
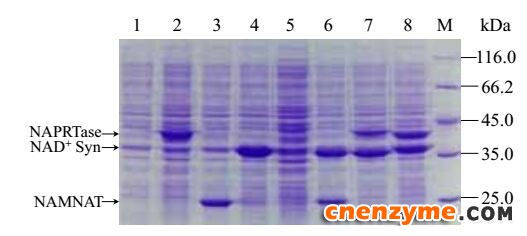 |
| 图 5 双酶共表达重组菌株的SDS-PAGE分析Figure 5 SDS-PAGE analysis of recombinant strains for double-enzyme co-expression. Lane 1: BL21/pET-21a; lane 2: BL21/pET-21a-pncB; lane 3: BL21/pET-21a-nadD; lane 4: BL21/pET-21a-nadE; lane 5: BL21/pET-21a-pncB -nadD; lane 6: BL21/pET-21a-nadD -nadE; lane 7: BL21/pET-21a-pncB -nadE; lane 8: BL21/pET-21a-nadE -pncB; M: protein cellular marker. |
|
图选项
|
与E. coli BL21/pET-21a相比,NAD+合成途径中关键酶组合共表达后,对于NAD+的含量和细胞干重产生了不同的效应。在生物量上,与E. coli BL21/pET-21a相比,共表达双基因重组菌均有所提高。在NAD+含量上,重组菌株虽然均有所提高,但是它们之间也存在较大的差异性。E. coli BL21/pET-21a-pncB -nadD胞内NAD+含量相对比例为148%,略低于单个表达基因pncB和nadD;E. coli BL21/pET-21a-nadD -nadE胞内NAD+含量相对比例为372%,与过表达单个基因nadE时提高了2.75倍基本一致;而E. coli BL21/pET-21a-pncB -nadE和E. coli BL21/pET-21a-nadE -pncB都具有叠加效应,比单个基因过量表达时效果更好,这两者之间由于次序不同,NAD+含量相差3 μmol/g DCW,提高的比例相差77.7%,E. coli BL21/pET-21a-nadE -pncB相对E. coli BL21/pET-21a-pncB -nadE提高了18.2%。
2.3 诱导条件对NAD+合成的影响重组菌株中E. coli BL21/pET-21a-nadE -pncB合成NAD+的能力最强,为了探究诱导条件对该重组菌株胞内NAD+合成积累的影响,对诱导条件进行优化,包括诱导温度、诱导时机、诱导时长和IPTG添加量。
测定不同诱导温度下E. coli BL21/pET-21a-nadE -pncB的NAD+含量(图 6-A),发现诱导温度对辅酶含量影响很大。诱导温度高于25 ℃时,NAD+的含量下降明显。过高的诱导温度会影响酶的活性和表达,导致关键酶NAPRTase和NAD+synthetase表达不正常,影响NAD+的合成[14]。当诱导温度维持在15-20 ℃之间,辅酶含量较高,且波动较小,表明低温有利于胞内NAD+的合成和积累。
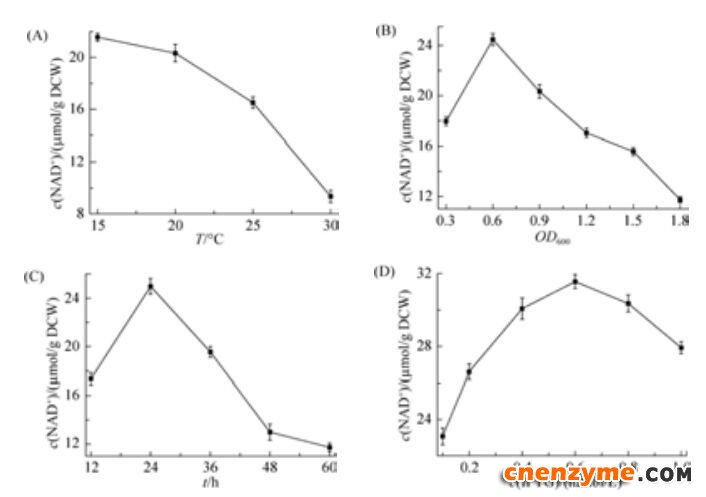 |
| 图 6 诱导条件优化对NAD+含量的影响Figure 6 Effect of inducing conditions optimization on the content of NAD+. A: effect of induction temperture on NAD+ content. B: effect of induced occasion on NAD+ content. C: effect of induction duration on NAD+ content. D: effect of IPTG content on NAD+ concentration. Standard deviation is the dispersion degree of 3 parallel experimental data relative to mean value. Data in A, B, C and D are the mean±S.D. of triplicate samples. |
|
图选项
|
不同浓度的诱导剂对E. coli BL21/pET-21a-nadE -pncB胞内NAD+的影响较大(图 6-D),发现随着IPTG添加量的增加,NAD+含量的变化趋势是先增加后降低,当IPTG浓度达到0.6 mmol/L时,NAD+含量到达较大值,IPTG浓度维持在0.4-0.8 mmol/L时,NAD+含量能够稳定在30 μmol/g DCW。
诱导时机和诱导时长对NAD+含量也有一定的影响(图 6-B/C),在OD600为0.6时诱导最佳。诱导培养24 h辅酶含量达到较大值,随着时间继续延长,辅酶的含量开始下降。发酵后期培养时间过长,不仅造成培养基中的营养物质不足,大肠杆菌生长受到抑制,而且随着代谢副产物的大量生成,会不断消耗NAD (H)[21]。因此,控制诱导时长对辅酶NAD+的积累量有重要意义。
2.4 前体物质对NAD+合成的影响NAD (H)从头合成途径是以天冬氨酸、色氨酸或者喹啉酸为前体,而补救合成途径中是以烟酸和烟酰胺作为烟酸单核苷酸(NaMN)的前体,进一步合成NAD+。因此,添加终浓度为20 mg/L的前体物质:色氨酸、天冬氨酸、喹啉酸、烟酸和烟酰胺,分别测定胞内辅酶NAD+含量以及生物量的变化情况。
由表 4可知,添加不同的前体物质,对共表达重组菌E. coli BL21/pET-21a-nadE -pncB胞内NAD+的含量均有一定的影响,其中添加烟酸的效果最为明显,较空白对照组提高69.4%。当细胞内大量存在上述NAD+前体时,补救途径中被强化的关键酶NAPRTase和NAD+ synthetase,大量利用前体物质重新合成NAD+。
| Different precursors | c(NAD+)/(μmol/g DCW) | Biomass liveweight/(g DCW/L) | Relative ratio/% |
| Control group | 18.98±0.93 | 1.23±0.05 | 100 |
| Tryptophane | 23.53±1.33 | 1.01±0.04 | 123.97 |
| Aspartic acid | 25.39±1.10 | 1.14±0.07 | 133.77 |
| Quinolinic acid | 27.96±0.91 | 1.12±0.07 | 147.31 |
| Nicotinamide | 29.64±1.27 | 1.13±0.06 | 156.16 |
| Nicotinic acid | 32.16±1.28 | 1.24±0.06 | 169.44 |
优化烟酸的添加量(图 7),当烟酸浓度为15-20 mg/L时,NAD+含量维持在32 μmol/g DCW左右,而当添加的烟酸超过20 mg/L后NAD+含量逐渐下降。随着烟酸浓度的增加,整个培养基的pH值也有一定的降低,烟酸含量超过40 mg/L时,pH降低至6.5左右。因此,控制烟酸的添加量是提高胞内辅酶含量要考虑的重要因素之一。
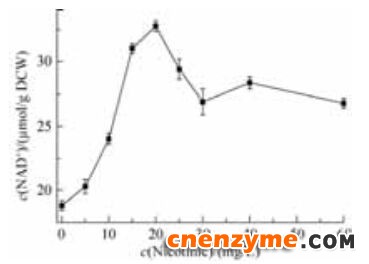 |
| 图 7 不同浓度烟酸对NAD+含量的影响Figure 7 Effect of different concentrations of nicotinic acid on the NAD+ content. Standard deviation is the dispersion degree of 3 parallel experimental data relative to mean value. Data in figure is the mean±S.D. of triplicate samples. |
|
图选项
|
2.5 响应面优化NAD+合成的发酵条件
2.5.1 响应面试验设计与结果分析: 在单因素优化结果的基础上,选择对NAD+含量影响较大的3个因素(IPTG浓度、烟酸浓度和诱导时长),取-1、0、1代表量的3个水平,以NAD+含量为响应值建立二次响应面分析模型。共进行17个试验,其中12个为析因点,5个为零点用于估算误差。每个试验重复3次,实验结果表示为测定结果的平均值正负标准偏差。响应面因素与水平见表 5。
| Factors | Level | ||
| -1 | 0 | 1 | |
| c(A-IPTG)/(mmol/L) | 0.4 | 0.6 | 0.8 |
| c(B-Nicotinic acid)/(mg/L) | 10.0 | 15.0 | 20.0 |
| C-induction duration/h | 20.0 | 24.0 | 28.0 |
利用Design-Expert 8.0对响应面实验结果(表 6)进行二次多元回归分析,除去不显著项得到模型的二次多项回归方程为:Y =42.47+1.44 A + 1.37 B -1.26 AC -4.81 A 2-4.47 B 2-1.52 C 2。由表 7可知,模型P < 0.0001,而失拟项不显著(P =0.1853 > 0.05)。同时,复相关系数RAdj2为97.7%,说明该模型具有拟合度好、误差较小的特点,可用于预测NAD+含量的最佳条件。
| Numbers | Factors | NAD+ content/(μmol/g) | |||
| A | B | C | Actual value | Predicted value | |
| 1 | 0 | 1 | -1 | 36.81±0.30 | 37.40 |
| 2 | 0 | -1 | -1 | 35.62±0.32 | 35.26 |
| 3 | -1 | 0 | 1 | 35.90±0.07 | 36.06 |
| 4 | -1 | 0 | -1 | 33.61±0.55 | 33.34 |
| 5 | 1 | -1 | 0 | 32.49±1.57 | 32.82 |
| 6 | 0 | 0 | 0 | 42.38±0.17 | 42.47 |
| 7 | 1 | 0 | -1 | 38.89±0.39 | 38.73 |
| 8 | 0 | 1 | 1 | 38.06±0.26 | 38.22 |
| 9 | 0 | 0 | 0 | 41.98±0.18 | 42.47 |
| 10 | -1 | -1 | 0 | 30.32±0.43 | 30.75 |
| 11 | 1 | 1 | 0 | 36.88±0.29 | 36.38 |
| 12 | 0 | 0 | 0 | 42.75±0.16 | 42.47 |
| 13 | 0 | 0 | 0 | 42.12±0.18 | 42.47 |
| 14 | 1 | 0 | 1 | 36.13±0.31 | 36.40 |
| 15 | 0 | -1 | 1 | 35.42±0.29 | 34.83 |
| 16 | 0 | 0 | 0 | 43.10±0.16 | 42.47 |
| 17 | -1 | 1 | 0 | 33.06±0.27 | 32.73 |
| Source | df | Sum of squares | Mean square | F | P | Significance |
| Model | 9 | 248.30 | 27.59 | 76.49 | < 0.0001 | Significant |
| A-IPTG content | 1 | 16.53 | 16.53 | 45.83 | 0.0003 | |
| B-NA content | 1 | 15.02 | 15.02 | 41.63 | 0.0003 | |
| C-induction duration | 1 | 0.042 | 0.042 | 0.12 | 0.7428 | |
| AB | 1 | 0.68 | 0.68 | 1.89 | 0.2199 | |
| AC | 1 | 6.38 | 6.38 | 17.68 | 0.0040 | |
| BC | 1 | 0.53 | 0.53 | 1.46 | 0.2666 | |
| A2 | 1 | 97.49 | 97.49 | 270.28 | < 0.0001 | |
| B2 | 1 | 84.01 | 84.01 | 232.91 | < 0.0001 | |
| C2 | 1 | 9.75 | 9.75 | 27.03 | 0.0013 | |
| Residual | 7 | 2.52 | 0.36 | |||
| Lack of fit | 3 | 1.68 | 0.56 | 2.65 | 0.1853 | Not significant |
| Pure error | 4 | 0.85 | 0.21 | |||
| Total | 16 | 250.82 |
2.5.2 响应曲面图分析: IPTG添加量、烟酸添加量和诱导时长3个因素间交互作用对NAD+含量的影响如图 8所示。IPTG与诱导时长交互作用对NAD+的影响较大,其曲线图最陡峭,随着IPTG浓度和诱导时长的增加,NAD+含量呈先上升后降低的趋势。然而,AB以及BC之间的交互作用对NAD+含量的曲面图较为平滑,影响不显著。
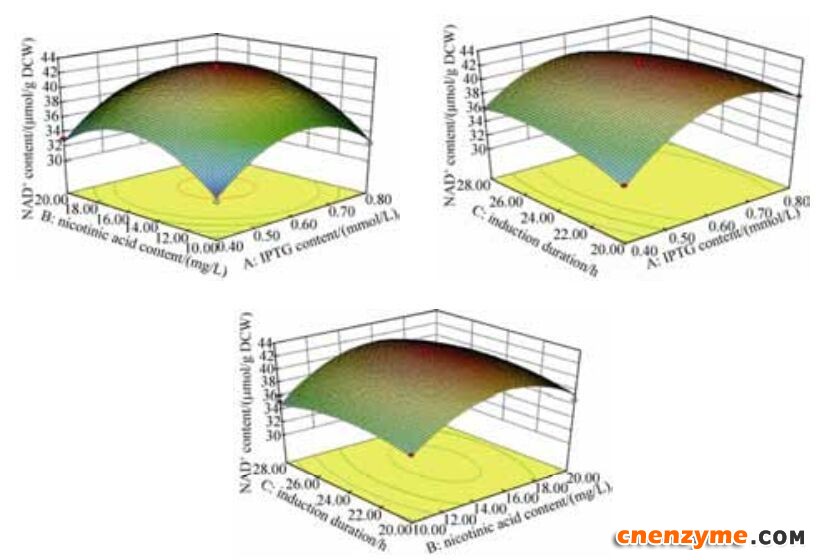 |
| 图 8 3个因素交互作用对NAD+含量影响的响应面Figure 8 Three-dimensional curved surface for effect of 3 factors interaction on NAD+ content. |
|
图选项
|
2.5.3 验证试验结果: 在实验因素的水平范围内预测菌株E. coli BL21/pET-21a-nadE -pncB胞内NAD+含量的最佳培养条件为:IPTG添加量0.63 mmol/L、烟酸添加量15.8 mg/L、诱导时长为24 h,此时的NAD+含量理论预计值为42.69 μmol/g DCW。在最优条件下进行3次验证试验检验回归方程预测结果,实际得到的NAD+含量为(43.16±0.65) μmol/g DCW,与理论值的平均误差小于5%。试验结果验证了模型所得到的二次多项回归方程可较准确地预测NAD+含量。3 讨论
论文采用单基因过量表达和双基因共表达策略,通过调节表达量考察了合成途径3个关键酶对辅酶NAD+合成水平的影响,研究发现单基因过表达重组菌E. coli BL21/pET-21a-pncB、E. coli BL21/pET-21a-nadD和E. coli BL21/pET-21a-nadE胞内NAD+含量分别提高了252.4%、101.7%和275.4%。三者之间存在的差异可能是由于基因nadD编码的烟酸单核苷酸腺苷酰转移酶(NAMNAT)既可以催化烟酸单核苷酸(NaMN)生成烟酸腺嘌呤二核苷酸(NaAD)又可以降解NAD+生成烟酰胺单核苷酸(NMN)[13, 22]。结合实验数据和文献,发现基因pncB和nadE提高NAD+含量的能力比基因nadD强。
结合双基因共表达重组菌株的实验数据和NAD+合成路径来看,脱氨基的NAD+在NAD+合成酶催化下氨基化生成NAD+可能直接影响了NAD+的合成量,基因nadE在宿主菌E. coli BL21中对NAD+合成量贡献更大。其中,重组菌E. coliBL21/pET-21a-nadE -pncB的NAD+含量提高405.2%,结果表明在研究对象E. coli BL21中,烟酸磷酸核糖转移酶和NAD+合成酶在NAD+合成途径中起到了关键性的作用。
通过对重组菌株BL21/pET-21a-nadE -pncB的诱导条件和NAD+合成途径的关键前体物质进行研究和优化,增加了蛋白的表达量并保证了菌体生长代谢的良好环境,有利于NAD+含量的增加与积累,使胞内NAD+水平维持在32 μmol/g DCW左右。
利用响应面分析优化IPTG浓度、烟酸浓度及诱导时长,确定最佳发酵条件,当诱导温度控制在15-20 ℃,在OD600为0.6-0.8时添加IPTG0.63 mmol/L,烟酸15.8 mg/L,诱导时长24 h,E. coli BL21/pET-21a-nad E-pncB胞内辅酶含量能达到43.16 μmol/g DCW左右。与未优化前相比,胞内NAD+含量提高了123.6%,与未强化NAD+合成途径的初始菌株E. coli BL21/pET-21a相比提高了1029.8%。对利用细胞自身辅酶NAD+,促进微生物最大化的合成目标代谢产物,增加代谢速率,提高氧化还原反应中生物催化效率具有较好的借鉴性。
References
[1] Bakker BM, Overkamp KM, van Maris AJA, Kötter P, Luttik MAH, van Dijken JP, Pronk JT. Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae. FEMS Microbiology Reviews, 2001, 25(1): 15-37. DOI:10.1111/j.1574-6976.2001.tb00570.x
[2] Berríos-Rivera SJ, Bennett GN, San KY. metabolic engineering of Escherichia coli:increase of NADH availability by overexpressing an NAD+-dependent formate dehydrogenase. metabolic Engineering, 2002, 4(3): 217-229. DOI:10.1006/mben.2002.0227
[3] San KY, Bennett GN, Berrıos-Rivera SJ, Vadali RV, Yang YT, Horton E, Rudolph FB, Sariyar B, Blackwood K. metabolic engineering through cofactor manipulation and its effects on metabolic flux redistribution in Escherichia coli. metabolic Engineering, 2002, 4(2): 182-192. DOI:10.1006/mben.2001.0220
[4] Sánchez AM, Bennett GN, San KY. Effect of different levels of NADH availability on metabolic fluxes of Escherichia coli chemostat cultures in defined medium. Journal of Biotechnology, 2005, 117(4): 395-405. DOI:10.1016/j.jbiotec.2005.02.006
[5] Heux S, Cachon R, Dequin S. Cofactor engineering in Saccharomyces cerevisiae:expression of a HO2-forming NADH oxidase and impact on redox metabolism. metabolic Engineering, 2006, 8(4): 303-314. DOI:10.1016/j.ymben.2005.12.003
[6] Vemuri GN, Altman E, Sangurdekar DP, Khodursky AB, Eiteman MA. Overflow metabolism in Escherichia coli during steady-state growth:transcriptional regulation and effect of the redox ratio. Applied and Environmental Microbiology, 2006, 72(5): 3653-3661. DOI:10.1128/AEM.72.5.3653-3661.2006
[7] Koebmann BJ, Westerhoff HV, Snoep JL, Nilsson D, Jensen PR. The glycolytic flux in Escherichia coli is controlled by the demand for ATP. Journal of Bacteriology, 2002, 184(14): 3909-3916. DOI:10.1128/JB.184.14.3909-3916.2002
[8] Liu LM, Li Y, Shi ZP, Du GC, Chen J. Enhancement of pyruvate productivity in Torulopsis glabrata:increase of NAD+ availability. Journal of Biotechnology, 2006, 126(2): 173-185. DOI:10.1016/j.jbiotec.2006.04.014
[9] 杨兴龙. 共表达亮氨酸脱氢酶与葡萄糖脱氢酶不对称合成光学纯L-叔亮氨酸. 江南大学学位论文, 2016.
[10] Wu XR, Jiang JP, Chen YJ. Correlation between intracellular cofactor concentrations and biocatalytic efficiency:coexpression of diketoreductase and glucose dehydrogenase for the preparation of chiral diol for statin drugs. ACS Catalysis, 2011, 1(12): 1661-1664. DOI:10.1021/cs200408y
[11] Berríos-Rivera SJ, San KY, Bennett GN. The effect of NAPRTase overexpression on the total levels of NAD, the NADH/NAD+ ratio, and the distribution of metabolites in Escherichia coli. metabolic Engineering, 2002, 4(3): 238-247. DOI:10.1006/mben.2002.0229
[12] Gou DM, Liang LY, Liu RM, Zhang CQ, Wu MK, Ma JF, Chen KQ, Zhu JG, Jiang M. Effect of overexpression of nicotinic acid mononucleotide adenylyltransferase on succinic acid production in Escherichia coli NZN111. Chinese Journal of Biotechnology, 2012, 28(9): 1059-1069. (in Chinese)
苟冬梅, 梁丽亚, 刘嵘明, 张常青, 吴明科, 马江锋, 陈可泉, 朱建国, 姜岷. 过量表达烟酸单核苷酸腺苷酰转移酶对大肠杆菌NZN111产丁二酸的影响. 生物工程学报, 2012, 28(9): 1059-1069.
[13] Jiang JP, Wu XR, Chen YJ. Strategy to solve cofactor issues in oxidoreductase catalyzed biocatalytic applications. Chinese Journal of Biotechnology, 2012, 28(4): 410-419. (in Chinese)
江金鹏, 吴旭日, 陈依军. 解决氧化还原酶反应体系中辅酶问题的策略及其应用. 生物工程学报, 2012, 28(4): 410-419.
[14] Wang CH, Li YY, Chen CH, Li X. Effects of temperature on the kinetics and level of energy charge and oxidation-reduction state in pyruvate biosynthesis. Chinese Journal of Biotechnology, 2006, 22(2): 316-321. (in Chinese)
王翠华, 李友元, 陈长华, 李啸. 温度对丙酮酸生物合成动力学、能荷和氧化-还原度的影响. 生物工程学报, 2006, 22(2): 316-321.
[15] Vinitsky A, Grubmeyer C. A new paradigm for biochemical energy coupling. Salmonella typhimurium nicotinate phosphoribosyltransferase. The Journal of Biological Chemistry, 1993, 268(34): 26004-26010.
[16] Li J, Chen KQ, Huang XM, Yang ZN, Jiang M, Wei P. Establishment of the determination of NAD+ and NADH in the anaerobic fermentation of organic acids. Food Science and Technology, 2008, 33(12): 254-257. (in Chinese)
李建, 陈可泉, 黄秀梅, 杨卓娜, 姜岷, 韦萍. 厌氧发酵有机酸体系中NAD+和NADH测定方法的建立. 食品科技, 2008, 33(12): 254-257. DOI:10.3969/j.issn.1005-9989.2008.12.066
[17] Gibon Y, Larher F. Cycling assay for nicotinamide adenine dinucleotides:NaCl precipitation and ethanol solubilization of the reduced tetrazolium. Analytical Biochemistry, 1997, 251(2): 153-157. DOI:10.1006/abio.1997.2283
[18] Sestini S, Jacomelli G, Pescaglini M, Micheli V, Pompucci G. Enzyme activities leading to NAD synthesis in human lymphocytes. Archives of Biochemistry and Biophysics, 2000, 379(2): 277-282. DOI:10.1006/abbi.2000.1888
[19] Yamada K, Hara N, Shibata T, Osago H, Tsuchiya M. The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry. Analytical Biochemistry, 2006, 352(2): 282-285. DOI:10.1016/j.ab.2006.02.017
[20] Al-Abady ZN, Durante B, Moody AJ, Billington RA. Large changes in NAD levels associated with CD38 expression during HL-60 cell differentiation. Biochemical and Biophysical Research Communications, 2013, 442(1/2): 51-55.
[21] Shen CR, Lan EI, Dekishima Y, Baez A, Cho KM, Liao JC. Driving forces enable high-titer anaerobic 1-butanol synthesis in Escherichia coli. Applied and Environmental Microbiology, 2011, 77(9): 2905-2915. DOI:10.1128/AEM.03034-10
[22] Dong WR, Sun CC, Zhu G, Hu SH, Xiang LX, Shao JZ. New function for Escherichia coli xanthosine phophorylase (xapA):genetic and biochemical evidences on its participation in NAD+ salvage from nicotinamide. BMC Microbiology, 2014, 14: 29. DOI:10.1186/1471-2180-14-29