1、学习酶的纯化方法,酶蛋白分离提纯的原理。
2、学习掌握细胞破壁、有机溶剂分级、透析和离子交换柱层析技术及分子筛层析技术。
3、学习独立设计实验应遵循的原则
二、实验原理:
蔗糖酶主要存在于酵母中,但工业上通常从酵母中制取。酵母蔗糖酶系胞内酶,提取时细胞破碎或菌体自溶。常用的提纯方法有盐析、有机溶剂沉淀、离子交换和凝胶柱层析。以此可得到较高纯度的酶。
细胞破壁的几种方法
1、高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。
2、玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。
3、反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
4、超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料。
5、化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好。
有机溶剂沉淀法即向水溶液中加入一定量的亲水性的有机溶剂可降低溶质的溶解度使其沉淀被析出。
三、试剂:
啤酒酵母 、 二氧化硅 、甲苯(使用前预冷到0℃以下)、去离子水(使用前冷至4℃左右)、1mol / L 醋酸 、95%乙醇
四、仪器:
研钵1个、离心管3个 、 3. 滴管3个、量筒50ml 1个、水浴锅1个、恒温水浴、烧杯100ml 2个、广泛pH试纸、高速冷冻离心机
四、操作步骤:
1. 提取
(1)准备一个冰浴,将研钵稳妥放入冰浴中。预先在冰箱中冷却20g干酵
母和10g二氧化硅。
(2)将20g干酵母粉和10g二氧化硅,放入研钵中。量取预冷的甲苯30ml缓慢加入酵母中,边加边研磨成糊状,约需60分钟。研磨时用显微镜检查研磨的效果,至酵母细胞大部分研碎。
(3)缓慢加入预冷的40ml去离子水,每次加2ml左右,边加边研磨,至少用30分钟。以便将蔗糖酶充分转入水相。
(4)缓慢加入预冷的40ml去离子水,每次加2ml左右,边加边研磨,至少用30分钟。以便将蔗糖酶充分转入水相。
(5)将混合物转入两个离心管中,平衡后,用高速冷离心机离心,4℃,10000rpm,10min。如果中间白色的脂肪层厚,说明研磨效果良好。用滴管吸出上层有机相。
(6)用滴管小心地取出脂肪层下面的水相,转入另一个清洁的离心管中,4℃,10000rpm,离心10min。
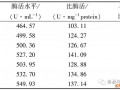
(7)将清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白含量。剩余部分转入清洁离心管中。
(8)用pH试纸检查清液pH,用1mol / L 醋酸将pH调至5.0,称为“粗级分I”。
(4)取沉淀研磨液上清液倒入小烧杯中,洗涤沉淀两次,把洗涤上清液倒入小烧杯中,分别把三个上清液定容至相同体积,取5ml 上清液,用冷冻离心机在温度4℃,转速15000r /min 条件下离心15min。吸取上清液,用1mol / L 醋酸分别调pH 至5.0。
2. 热处理
(1)预先将恒温水浴调到50℃,将盛有粗级分I的离心管稳妥地放入水浴中,45℃下保温30分钟,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,10000rpm,离心15min。
(3)将上清液转入量筒,量出体积,留出1.5ml测定酶活力及蛋白质含量(称为“热级分II”)。
3. 乙醇沉淀
将热级分II转入小烧杯中,放入冰盐浴(没有水的碎冰撒入少量食盐),逐滴加入等体积预冷至-20℃的95%乙醇,同时轻轻搅拌,共需30分钟,再在冰盐浴中放置10分钟,以沉淀完全。于4℃,10000rpm,离心10min,倾去上清,并滴干,沉淀保存于离心管中,盖上盖子或薄膜封口,然后将其放入冰箱中冷冻保存(称为“醇级分Ⅲ”)。
废弃上清液之前,要用尿糖试纸检查其酶活性(于下一个实验一起做)。
(二)凝胶层析纯化蔗糖酶
① 装柱:将密实海绵垫装入玻璃柱底端,作为柱底支持物,装入定量的蒸馏水(约为柱体积的1/5),以避免胶粒直接冲击柱底支持物;
②用玻棒小心排除柱底和柱内的气泡;
③固定玻璃柱,调整垂直;
④边搅拌凝胶,边向柱内缓慢、连续、均匀地装入凝胶(打开柱底端的螺旋夹)不要中断,使胶粒均匀沉降,以免胶面倾斜和发生断层;
⑤检查装好的凝胶柱用眼观察有无凝胶分层、沟流和气泡现象;
⑥表观无毛病,用缓冲溶液平衡凝胶柱,流速控制在2-3s/滴;
⑦上样:将柱中的缓冲液逐渐放出,当顶部液面达到近于柱床表面时,开始用细长的玻管沿柱壁绕环加入酶液,待样液达2cm后再在柱中间小心加样,注意控制流速;上样量控制在柱体积的2%-5%;
⑧洗脱:用适量缓冲液冲洗凝胶柱顶端柱壁,连接横压洗脱瓶,开始层析;
⑨收集酶活力峰:确定酶活力峰的位置,量体积V4。取适量稀释后用DNS测活性、Folin酚测蛋白浓度。于4℃保存。
(中国酶制剂整理www.cnenzyme.com)